
| A. | 2 mol/L | B. | 1.8 mol/L | C. | 1.9 mol/L | D. | 无法计算 |
分析 向一定量的Fe、Fe2O3、CuO混合物中,加入100mL 2.2mol/L的硫酸,充分反应后滤去不溶物,溶液中计算阳离子只有Fe2+,向滤液中加入2mol/L的NaOH溶液至40mL时开始出现沉淀,说明硫酸有剩余,说明反应后溶液中溶质为FeSO4、H2SO4,根据消耗NaOH可以计算滤液中c(H+),溶液中SO42-离子浓度不变,由电荷守恒可知2c(Fe2+)+c(H+)=2c(SO42-).
解答 解:向一定量的Fe、Fe2O3、CuO混合物中,加入100mL 2.2mol/L的硫酸,充分反应后滤去不溶物,溶液中计算阳离子只有Fe2+,向滤液中加入2mol/L的NaOH溶液至40mL时开始出现沉淀,说明硫酸有剩余,说明反应后溶液中溶质为FeSO4、H2SO4,
则滤液中n(H+)=n(NaOH)=0.04L×2mol/L=0.08mol,故c(H+)=$\frac{0.08mol}{0.1L}$=0.8mol/L,溶液中SO42-离子浓度不变,故c(SO42-)=2.2mol/L,由电荷守恒可知2c(Fe2+)+c(H+)=2c(SO42-),即2c(Fe2+)+0.8mol/L=2×2.2mol/L,解得c(Fe2+)=1.8mol/L,
故选B.
点评 本题考查混合物计算,关键是判断混合物与硫酸反应后溶液中溶质,再结合硫酸根浓度不变与电荷守恒解答,较好地考查学生分析计算能力.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
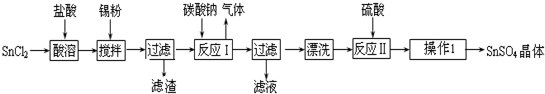
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水,浓H2SO4 | B. | 酸性KMnO4溶液,浓H2SO4 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓H2SO4,酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
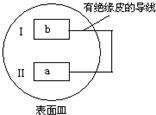 把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )| A. | a是原电池的负极 | B. | b的活泼性大于a | ||
| C. | 无电流产生 | D. | b 电极上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 因为氧化铁是一种碱性氧化物,所以常用作红色油漆和涂料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com