
【题目】N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+ ![]() O2(g)=
O2(g)= ![]() N2(g)+H2O(l)△H=+267kJmol﹣1
N2(g)+H2O(l)△H=+267kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
【答案】D
【解析】解:A、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,其焓变是负值,故A错误;
B、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,故B错误;
C、N2H4(g)完全燃烧生成氮气和气态水时,放出热量,其焓变是负值,故C错误;
D、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1,故D正确.
故选D.
根据热化学方程式的意义以及热化学方程式的书写方法可知,书写热化学方程式时应标注物质的聚集状态,放热反应的反应热为负值,化学计量数要和反应热成比例,据此解答.


科目:高中化学 来源: 题型:
【题目】某氧化物与 NaOH 溶液反应生成易溶于水的化合物 M,将少量 M 溶液滴入稀盐酸中,有白色沉淀产生,则该氧化物是
A.Fe2O3B.SiO2C.A12O3D.MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】春秋季节在我市常出现大雾天气,对于这种现象下列说法正确的是
A.大雾是由于空气中的SO2超标造成的
B.大雾可看作是一种分散剂为水的分散系
C.大雾可看作是一种胶体
D.大雾是由于空气中的粉尘超标造成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸或稀盐酸中,观察产生气泡的快慢,据此确定它们的活动性.该原理的离子方程式为 .
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性.试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,
并写出电极反应式.正极反应式:;负极反应式:;
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案与方案Ⅰ、Ⅱ不能雷同: , 用离子方程式表示其反应原理: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
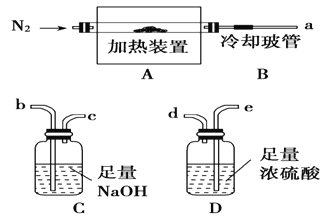
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式___________________________。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为________(按气流方向,用接口字母表示),其中C的作用是________。装置连接后,首先要进行的操作的名称是________。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2的作用是______________________、_________________等。
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x=________。若取消冷却玻管B后进行实验,测定的x值将________(填“偏高”或“偏低”)。
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1-2y·(CO3)y·zH2O],该生成物能发生类似的热分解反应。现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁还原热解制备高纯氧化镁是一种新的探索,以解决氧化镁在医药、建筑等行业的应用广泛。现以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)酸溶所涉及反应的离子方程式为_________________________________________、_________________________________________________________。
(2)加入H2O2氧化的作用是_________________,滤渣2的成分是___________(填化学式)。
(3)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①B中盛放的溶液可以是______(填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c. KMnO4溶液 d. 稀硝酸
②C装置的作用是______________________,D中收集的气体可以是 _______(填化学式)。
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,水溶液中c(H+)与c(OH﹣)的变化关系如图中曲线 ac所示,下列判断错误的是( ) 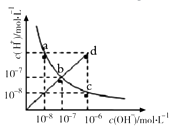
A.ac曲线上的任意一点都有c(H+)×c(OH﹣)=10﹣14
B.CH3COONa溶液不可能位于c点
C.d点对应溶液的温度高于25°C,PH<7
D.bd线段上任意一点对应的溶液都呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用合成气(主要成分为CO2、H2、CO)在催化剂作用下合成甲醇,并可用甲醇合成甲醚。
(1)CO2的电子式是________。
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1 = -90.77 kJ/mol
CH3OH(g) △H1 = -90.77 kJ/mol
CO2 (g)+H2 (g)![]() CO(g)+H2O(g) △H2 = +41.19 kJ/mol
CO(g)+H2O(g) △H2 = +41.19 kJ/mol
则CO2与H2反应制备CH3OH(g)的热化学方程式是________。
(3)向三个体积均为1L的恒容密闭容器中分别充入1mol CO2和3mol H2,在不同催化剂作用下同时反应制备CH3OH(g)。测得H2转化率随温度变化的数据如下表所示。

(注:T5时,H2转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“I”“II”或“III”)。
②T3时,反应I的v(正)________v(逆)(填“>”“<”或“=”)。
③温度为T5时,该反应的平衡常数K=________。
(4)甲醇合成甲醚的反应为2CH3OH(g)![]() CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)
CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)![]() C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:
C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:

①反应速率较快的是________(填“Ⅰ”或“Ⅱ”),原因是________。
②根据反应原理,分析增大压强对合成甲醚的影响________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com