
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要合氯消毒剂和漂白剂亚氯酸钠(NaClO2),工艺流程如下:
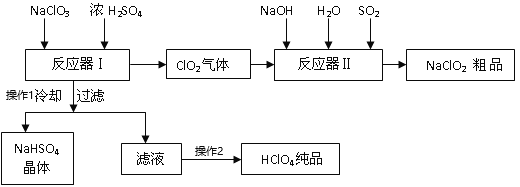
已知:a. NaHSO4的溶解度随着温度的升高而增大,适当条件下可结晶析出;
b.高氯酸是至今为止人们已知酸中的最强酸,沸点:90℃。
(1)操作①冷却过滤的目的是__________________
(2)反应器I中发生化学反应的方程式是_________________,反应器I中的温度最佳为__________(填序号);操作②的名称为______________。
A.0℃ B. 20℃ C. 80℃ D. 120℃
(3)反应器II中发生反应的离子方程式为_________;SO2的作用为_______________(氧化剂、还原剂)。
(4)加快反应器II中反应速率的措施有___________(写出2种措施即可)等。从反应器II中获得NaClO2粗品的实验操作依次是______________(选序号,下同),进一步提纯的操作名称为______________
A.过滤 B.重结晶 C.蒸馏 D.蒸发浓缩 E.蒸干灼烧 F.冷却结晶
【答案】降低NaHSO4的溶解度,使NaHSO4结晶析出 3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O C 蒸馏 2ClO2+SO2+4OH=2ClO2-+SO42+2H2O 还原剂 适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积(写出两条即可) DFA B
【解析】
NaClO3和浓H2SO4在反应器I中反应:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O,生成HClO4、ClO2和NaHSO4,ClO2在反应器II中与二氧化硫、氢氧化钠反应2ClO2+SO2+4NaOH═2NaClO2+Na2SO4+2H2O,生成亚氯酸钠,再得到其晶体;反应器I中得到的溶液通过冷却过滤得到NaHSO4晶体,滤液为HClO4,蒸馏得到纯净的HClO4,据此分析。
(1)已知:NaHSO4的溶解度随着温度的升高而增大,故用冷却过滤的目的是降低NaHSO4的溶解度,使NaHSO4结晶析出;
故答案为:降低NaHSO4的溶解度,使NaHSO4结晶析出;
(2)由图可知,NaClO3和浓H2SO4在反应器I中反应,生成物有HClO4、ClO2、NaHSO4等,根据原子守恒、化合价升降守恒配平其方程式为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;反应器I中加入的氯酸钠在浓硫酸的作用下发生了氧化还原反应,得到ClO2气体和高氯酸,所以要得到较高浓度的高氯酸溶液,应该尽可能的升温使ClO2气体溢出,同时温度不能过高,超过高氯酸沸点温度90℃容易使高氯酸气化,所以最佳温度应该选C,80℃;而在后一阶段的滤液中再获得纯净的高氯酸产品,可以选择蒸馏,升高温度至高氯酸沸点温度,蒸馏得到高氯酸纯品;
故答案为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;C;蒸馏;
(3)从反应II的前后反应物和产物可以看出,发生了氧化还原反应,ClO2气体做氧化剂,SO2做还原剂在反应中被氧化为了SO42,有碱参与反应生成盐和水,反应的离子方程式为2ClO2+SO2+4OH=2ClO2-+SO42+2H2O;
故答案为:2ClO2+SO2+4OH=2ClO2-+SO42+2H2O;还原剂;
(4)影响反化学应速率的因素有温度、浓度、接触面积等,所以在反应器II中要加快反应速率,可以通过适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积等措施来改变;若要从从反应器II中获得NaClO2晶体粗品,可以通过蒸发浓缩、冷却结晶、过滤的方法得到,故选DFA;进一步提纯粗品晶体,则应该对该粗产品进行重结晶处理;
故答案为:适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积等;DFA;B;
故答案为:适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积(写出两条即可);DFA;B。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/Lr溶液的pH为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是( )
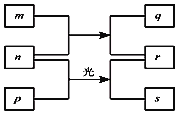
A.原子半径的大小![]()
B.元素的非金属性![]()
C.Y的氢化物常温常压下为气态
D.X的最高价氧化物对应的水化物为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
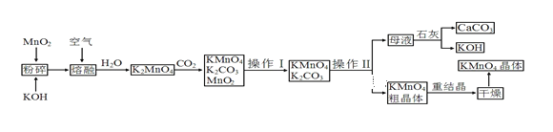
(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____物质相似。
A 75%酒精 B 双氧水 C 苯酚 D “84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是________;
(3)上述流程中可以循环使用的物质有石灰、CO2、____,____;(写化学式)。
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是_______。
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:___________。
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的方程式正确的是
A.蔗糖与浓硫酸混合产生刺激性气味的气体:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Cu溶于稀硝酸HNO3:Cu+2H++NO3—=Cu2++NO2↑+H2O
C.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42—=BaSO4↓
D.Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
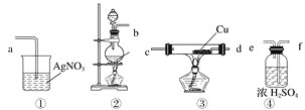
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的氧气和二氧化碳相比较,下列叙述正确的是( )
A.质子数之比为1:1B.密度比为11:8C.物质的量之比为8:11D.原子个数比1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2和Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的体积关系如图所示,则原溶液中MgCl2和Al2(SO4)3的物质的量浓度之比为( )

A. 1:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中现用Fe与盐酸反应制取22.4L H2(标准状况下)。
(1)消耗Fe的物质的量为________
(2)如果选用所贴标签为2.0molL-1的盐酸,至少需该盐酸________升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com