
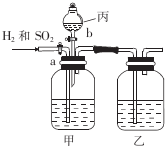
 Ϊ�˷���H2��SO2�����ֱ�õ���������壬ijѧ�������һ��ʵ��װ�ã���a��bΪ��������ÿ��װ���е���Һ��������
Ϊ�˷���H2��SO2�����ֱ�õ���������壬ijѧ�������һ��ʵ��װ�ã���a��bΪ��������ÿ��װ���е���Һ������������ ����H2��SO2�����ֱ�õ���������壬��ʵ��װ�ÿ�֪��������Һ©������Ϊϡ���ᣬ����ΪNaOH��Һ��������������ж���������NaOH��Ӧ�����������ܷ�Ӧ����Ӽ����ݳ�������Ȼ����������Ũ������T�ɵõ������������Ȼ���Һ©���Ļ����������������������Ƶķ�Ӧ���ɶ����������壬��ͨ������Ũ�������õ�����Ķ����������壬�Դ������
��� �⣺����H2��SO2�����ֱ�õ���������壬��ʵ��װ�ÿ�֪��������Һ©������Ϊϡ���ᣬ����ΪNaOH��Һ��������������ж���������NaOH��Ӧ�����������ܷ�Ӧ����Ӽ����ݳ�������Ȼ����������Ũ������T�ɵõ������������Ȼ���Һ©���Ļ����������������������Ƶķ�Ӧ���ɶ����������壬��ͨ������Ũ�������õ�����Ķ����������壬
��1����ͼ��֪���������������Ƿ�Һ©�����ʴ�Ϊ����Һ©����
��2��������Ϊ���ն�������ʹ�����������룬���������ʢ��ҺΪNaOH���������ɸ������������������������ԣ�������ʢŨ���ᣬ
�ʴ�Ϊ��C��A��
��3��ʵ��ʱ�ر�b����a����������������NaOH�ķ�Ӧ�����������ƣ���NaOH������һ��ʱ�����е�������NaOH��Na2SO3���ʴ�Ϊ��NaOH��Na2SO3��
��4����������һ������ر�a����b�������������������Ƶķ�Ӧ���ɶ����������壬��ͨ������Ũ�������õ�����Ķ����������壬�������õ���������SO2��
�ʴ�Ϊ��a��b��SO2��
���� ���⿼������ʵ�鷽������ƣ�Ϊ��Ƶ���㣬�������ʵ����ʡ������ķ�Ӧ��ʵ��װ�õ����õ�Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ���ۺ�Ӧ�ã���Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 254gI2��g����ͨ��2gH2��g������Ӧ����9.48kJ | |
| B�� | ����Ӧ������52.96kJ����ʱת��2mole- | |
| C�� | ��Ӧ�ڵķ�Ӧ���������ȷ�Ӧ�ٵķ�Ӧ���������� | |
| D�� | 1mol��̬����1mol��̬�����17.00kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Ҫͨ����ܷ������� | |
| B�� | ����ﵽ����ƽ��ʱ�������ڣ�CH3COO-+H+?CH3COOH | |
| C�� | H2SO4�ǹ��ۻ������������������� | |
| D�� | ����ƽ�����ƣ�����ʷ��ӵ�Ũ�Ȳ�һ����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��PH=a��NaOH��Һ��ˮϡ����10n��������Һ��PH��Ϊa-n | |
| B�� | ��Ũ�ȵİ�ˮ��NH4Cl��Һ�������Ϻ�c��NH${\;}_{4}^{+}$��+c��H+����c��NH3•H2O��+c��OH-�� | |
| C�� | ��NaOH��Һ����μ���CH3COOH��Һ��PH=7��ˮ�ĵ���̶������� | |
| D�� | PH=5.6��NaHSO3��Һ��c��Na+����c��HSO${\;}_{3}^{_}$����c��H2SO3����c��SO${\;}_{3}^{2-}$�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.00 mol NaCl ��� 6.02��1023������ | |
| B�� | 1.00 mol NaCl �У�����Na+�ĵ�������Ϊ 10��6.02��1023 | |
| C�� | ������ 1.00 L 1.00 mol/L ��NaCl��Һ���ɽ� 58.5gNaCl���� 1.00L ˮ�� | |
| D�� | ��� 58.5g ���ڵ� NaCl���ܲ���22.4L��������״������23.0g ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �˷�ӦΪ���ȷ�Ӧ | |
| B�� | ����1 molʯī�Ļ�ѧ����Ҫ���յ�����С������1 mol���ʯ��ѧ�����ų������� | |
| C�� | ʯī�Ƚ��ʯ�ȶ� | |
| D�� | �˱仯Ϊ�����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ú���еļ���������ֲ����徭����Ͷ����� | |
| B�� | ��Ȼ������Ҫ�ɷ��Ǽ��� | |
| C�� | ������û����ɫ��û����ζ�����壬��������ˮ | |
| D�� | ��������������ȡ����Ӧ�����ɵIJ������ȼ�����һ��Ч�ʽϸߵ����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com