
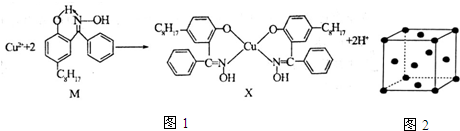
分析 (1))X难溶于水、易溶于有机溶剂,应属于分子晶体;
Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p43d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+;
(2)同周期自左而右电负性增大,非金属性越强电负性越大;分子中N原子形成2个σ键,含有1对孤电子对与铜离子形成配位键,N原子采取sp2杂化;
(3)酚羟基中O-H键断裂,N原子与酚羟基中的H原子之间氢键断裂,氧原子、N原子与铜离子之间形成配位键;
(4)以顶点Cu原子研究,与之最近的Cu原子位于面心,每个顶点为12的面共用.
解答 解:(1)X难溶于水、易溶于有机溶剂,应属于分子晶体;Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p63d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+,Cu2+的核外电子排布式为:1s22s22p63s23p63d9,
故答案为:原子晶体;1s22s22p63s23p63d9;
(2)同周期自左而右电负性增大,非金属性越强电负性越大,故电负性O>N>C>H;分子中N原子形成2个σ键,含有1对孤电子对与铜离子形成配位键,N原子采取sp2杂化,N原子以 sp2杂化轨道与O原子形成σ键,
故答案为:O>N>C>H;sp2杂化;
(3)酚羟基中O-H键断裂,N原子与酚羟基中的H原子之间氢键断裂,氧原子、N原子与铜离子之间形成配位键,故选:be;
(4)以顶点Cu原子研究,与之最近的Cu原子位于面心,每个顶点为12个面共用,铜晶体中每个铜原子周围距离最近的铜原子数目为12,
故答案为:12.
点评 本题是对物质结构的考查,涉及晶体类型与性质、核外电子排布、电负性、杂化轨道、化学键、晶胞结构等,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
 ;b 的结构简式
;b 的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 改变温度,反应中转移电子的物质的量n的范围:3amol≤n≤5amol | |
| B. | 改变温度,产物中NaCl的最小理论产量为4amol | |
| C. | 参加反应的氯气的物质的量3amol | |
| D. | 某温度下,若反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=6,则溶液中$\frac{c(C{l}^{-})}{c(C{O}_{3}^{-})}=\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 2c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) | |
| C. | c(K+)>c(Na+)>c(HCO3-)+c(CO32-)>c(OH-)>c(H+) | |
| D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大部分金属的冶炼都是通过高温下发生的氧化还原反应实现的 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 铝及其合金使用广泛,是因为铝比铁更耐酸、碱的腐蚀 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 嘴嚼米饭时有甜味(化学变化) | |
| B. | 玻璃窗破裂(化学变化) | |
| C. | 二氧化碳使澄清的石灰水变浑浊(物理变化) | |
| D. | 纯净物加热后变为混合物(物理变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入稀硝酸,无沉淀产生,然后再加硝酸钡溶液,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡溶液,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,无产生沉淀,然后再加氯化钡溶液,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡溶液,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com