
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1mol•L-1(NH4)2SO4溶液与0.2mol•L-1NH4Cl溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.21NA |
分析 A.3.36LC2H4和C3H6的混合气体物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,烯烃分子中含碳碳双键;
B、体积不知,所以无法由浓度求物质的量;
C、气体所处的状况不知;
D、NH4HSO4在水溶液中电离产生铵根离子、氢离子和硫酸根离子,根据电荷守恒分析解答.
解答 解:A.3.36LC2H4和C3H6的混合气体物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,若C3H6为烯烃,烯烃分子中含碳碳双键0.15NA,C3H6也可以为环烷烃,故A错误;
B、体积不知,所以无法由浓度求物质的量,则铵根离子的数目也就不知,故B错误;
C、气体所处的状况不知,所以无法由体积求气体的物质的量,故C错误;
D、根据电荷守恒可知:n(NH4+)+n(H+)=2n(SO42-)+n(OH-),而硫酸根离子的物质的量为0.1mol,所以n(NH4+)+n(H+)=0.2+n(OH-),所以阳离子数目略大于0.2NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意物质的量之间的换算是解题的关键,学生要学会电荷守恒在解题中巧妙的运用.


科目:高中化学 来源: 题型:选择题
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 56gN2与CO混合物中原子总数是4NA | |
| C. | 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA | |
| D. | 常温下,1LpH=l的H2SO4溶液中的H+为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
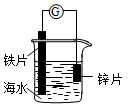
| A. | 锌片发生氧化反应作阴极 | |
| B. | 电子从铁片经过导线流向锌片 | |
| C. | 铁片上电极反应为:O2+2H2O+4e→4OH- | |
| D. | 该装置可用于研究外加电流阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL 10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙烯中所含的C-H 键数目为2NA | |
| D. | 0.1 mol NH3中所含的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
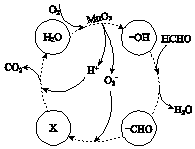 MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
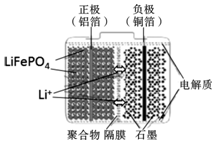 磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )
磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )| A. | 图中聚合物隔膜是阴离子交换膜 | |
| B. | 充电时,Li+迁移方向是“由右向左” | |
| C. | 放电时,正极的电极反应式为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| D. | 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com