
分析 (1)①根据溶液中的电荷守恒来回答;
②盐酸和氨水溶液恰好中和,指的是酸和碱的物质的量是相等的,此时得到的溶液为氯化铵溶液;
(2)①废液加入足量的AgNO3溶液,生成沉淀43.05g为AgCl质量,根据氯元素守恒计算溶液中n(FeCl3),根据c=$\frac{n}{V}$计算原废液中c(FeCl3);
②废液中加入硝酸发生反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,根据NO计算废液中n(Fe2+),再根据2Fe3++Cu=2Fe2++Cu2+,计算溶液中n(Cu2+)、参加反应Fe3+物质的量,进而计算废液中n(Fe3+),离子浓度之比等于物质的量之比;
③刚开始析出Cu时溶液中Fe2+的物质的量最小,Fe3+完全反应,发生反应:2Fe3++Fe=3Fe2+,Cu恰好完全析出时,溶液中Fe2+的物质的量最大,发生反应Cu2++Fe=Fe2++Cu,由(2)中数据结合方程式计算.
解答 解:(1)①当溶液pH=7时,即显示中性,c(H+)=c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),则溶液中c(NH4+)=c(Cl-),
故答案为:=;
②当盐酸和氨水溶液恰好中和时,指的是酸和碱的物质的量按照1:1反应,此时得到的溶液为氯化铵溶液,铵根离子水解导致溶液显示酸性,即c(H+)>c(OH-),故答案为:>;
(2)①废液加入足量的AgNO3溶液,生成沉淀43.05g为AgCl质量,其物质的量=$\frac{43.05g}{143.5g/mol}$=0.3mol,根据氯元素守恒,原溶液中n(FeCl3)=$\frac{1}{3}$n(AgCl)=$\frac{1}{3}$×0.3mol=0.1mol,故原废液中c(FeCl3)=$\frac{0.1mol}{0.05L}$=2mol/L,
故答案为:2mol/L;
②由3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,可知废液中n(Fe2+)=3n(NO)=0.02mol×3=0.06mol,根据2Fe3++Cu=2Fe2++Cu2+,可知溶液n(Cu2+)=$\frac{1}{2}$n(Fe2+)=$\frac{1}{2}$×0.06mol=0.03mol、参加反应Fe3+物质的量=n(Fe2+)=0.06mol,故废液中n(Fe3+)=0.1mol-0.06mol=0.04mol,离子浓度之比等于物质的量之比,故c(Fe3+):c(Fe2+):c(Cu2+)=0.04mol:0.06mol:0.03mol=4:6:3,
故答案为:4:6:3;
③刚开始析出Cu时溶液中Fe2+的物质的量最小,Fe3+完全反应,则:
2Fe3++Fe=3Fe2+
0.04mol 0.06mol
故Fe2+的物质的量极小值为0.06mol+0.06mol=0.12mol,由于析出Cu,故Fe2+的物质的量最小大于0.12mol,
Cu恰好完全析出时,溶液中Fe2+的物质的量最大,则:
Cu2++Fe=Fe2++Cu
0.03mol 0.03mol
故溶液中Fe2+的物质的量最大为0.12mol+0.03mol=0.15mol,
故溶液中0.12mol<n(Fe2+)≤0.15mol,
故答案为:0.12mol<n(Fe2+)≤0.15mol.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较及混合物反应的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、盐的水解原理的含义及应用方法.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题

| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
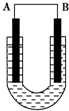 把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:
把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
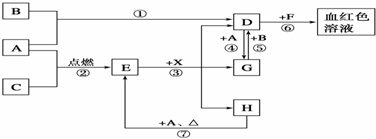
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
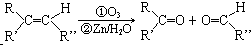

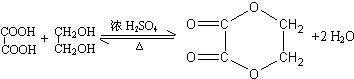 ;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、
;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、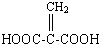 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
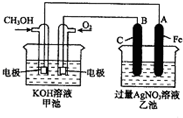 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将水滴造型与锌块相连 | B. | 将水滴造型与电源的负极相连 | ||
| C. | 将水滴造型与电源的正极相连 | D. | 进行多次人工降雨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com