
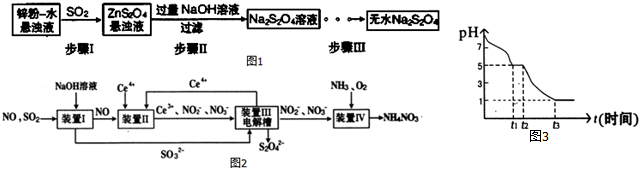
分析 (1)锌粉、水形成分散系,通入二氧化硫反应得到ZnS2O4,加入过量NaOH溶液反应得到Na2S2O4溶液,再经过加热浓缩、冷却结晶、过滤、洗涤等得到Na2S2O4晶体;
①增大锌反应的表面积;二氧化硫具有还原性,可以被硝酸氧化,盐酸易挥发,而10%的硫酸太稀,二氧化硫溶解度大,难以得到二氧化硫气体;
②用乙醇洗涤,消去可溶性杂质,并减少因溶解导致的损失,加入乙醇浸没沉淀,滤干后重复操作2-3次;
(2)①装置Ⅱ中,酸性条件下,NO被Ce4+氧化生成NO3-、NO2-,而Ce4+被还原为Ce3+氧化;
②电解槽阴极发生还原反应,SO32-被还原为S2O42-;
③根据电子转移守恒计算;
(3)0~t1段主要先生成HSO3-,溶液显酸性,说明HSO3-的电离程度大于水解程度,Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠;
t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠.
解答 解:(1)锌粉、水形成分散系,通入二氧化硫反应得到ZnS2O4,加入过量NaOH溶液反应得到Na2S2O4溶液,再经过加热浓缩、冷却结晶、过滤、洗涤等得到Na2S2O4晶体;
①将锌粉和水制成悬浊液的原因是:增大锌反应的表面积,加快化学反应速率,
二氧化硫具有还原性,可以被硝酸氧化,盐酸易挥发,制备的二氧化硫含有HCl,而10%的硫酸太稀,二氧化硫溶解度大,难以得到二氧化硫气体,故算则70%的硫酸,
故答案为:增大锌反应的表面积,加快化学反应速率;B;
②用乙醇洗涤,消去可溶性杂质,并减少因溶解导致的损失,洗涤过程的操作方法:加入乙醇至浸没沉淀,滤干后重复操作2-3次,
故答案为:加入乙醇至浸没沉淀,滤干后重复操作2-3次;
(2)①装置Ⅱ中,酸性条件下,NO被Ce4+氧化生成NO3-,而Ce4+被还原为Ce3+氧化,反应离子方程式为:NO+3Ce4++2H2O=NO3-+2Ce3++4H+,
故答案为:NO+3Ce4++2H2O=NO3-+2Ce3++4H+;
②电解槽阴极发生还原反应,SO32-被还原为S2O42-,电极反应式为:2SO32-+2H2O-2e-═S2O42-+4OH-,
故答案为:2SO32-+2H2O-2e-═S2O42-+4OH-;
③NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:$\frac{1000a}{46}$mol×2,设消耗标况下氧气的体积是V,则得到电子数目是:$\frac{V}{22.4}$nol×4,根据电子守恒:$\frac{1000a}{46}$mol×2=$\frac{V}{22.4}$nol×4,解得V=243a,
故答案为:243a;
(3)0~t1段主要先生成HSO3-,溶液显酸性,说明HSO3-的电离程度大于水解程度,Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,0~t1 发生离子反应方程式为:2S2O42-+O2+2H2O=4HSO3-,亚硫酸氢根的电离程度不大,而水也会电离产生氢离子,故t1时刻溶液中离子浓度由大到小的顺序是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠,则溶液中主要阴离子符号是SO42-,
故答案为:2S2O42-+O2+2H2O=4HSO3-;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);SO42-.
点评 本题考查物质制备工艺流程、气体制备、实验基本操作、氧化还原反应、陌生方程式书写、电解原理等,属于拼合型题目,是对学生综合能力的考查,为高考常考题型,注意对题目信息的应用,难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
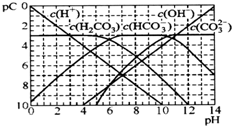
| A. | H2CO3、HCO3-、CO32-不能在同一溶液中大量共存 | |
| B. | H2CO3电离平衡常数Kal≈10-6 | |
| C. | pH=7时,溶液中存在关系(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | pH=9时,溶液中存在关系(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向葡萄糖溶液中加入足量NaOH溶液后,再加入新制氢氧化铜悬浊液,加热,可观察到产生黑色沉淀 | |
| B. | 向米汤中加入含碘的食盐,观察是否有颜色的变化,检验含碘食盐中是否含碘酸钾 | |
| C. | 向淀粉溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验,检验淀粉是否水解 | |
| D. | 向油脂中加入NaOH溶液再蒸馏,提纯油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,平衡常数增大 | |
| B. | 当v(CO2)正=$\frac{1}{2}$v(N2)逆时,说明反应达到平衡状态 | |
| C. | 增加CO的物质的量浓度,NO的转化率增大 | |
| D. | 增大压强,正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀 | 得红棕色溶液 | 溶液中含有Fe3+ |
| 取少量溶液于试管中,滴加0.05mol/L的酸性高锰酸钾溶液 | 溶液不褪色 | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1mol/L的氯化钡溶液,再加入20%稀硝酸溶液 | 有白色沉淀 | 溶液中含有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com