
”¾ĢāÄæ”æŅŃÖŖ25”ę Ksp£ØAg2S£©=6.3”Į10£50”¢Ksp£ØAgCl£©=1.5”Į10£16”£É³ŹŠÖŠŃ§Ä³ŃŠ¾æŠŌѧĻ°Š”×éĢ½¾æ
AgCl”¢Ag2S³Įµķ×Ŗ»ÆµÄŌŅņ”£
²½ Öč | ĻÖ Ļó |
¢ń£®½«NaClÓėAgNO3ČÜŅŗ»ģŗĻ | ²śÉś°×É«³Įµķ |
¢ņ£®ĻņĖłµĆ¹ĢŅŗ»ģŗĻĪļÖŠ¼ÓNa2SČÜŅŗ | ³Įµķ±äĪŖŗŚÉ« |
¢ó£®ĀĖ³öŗŚÉ«³Įµķ£¬¼ÓČėNaClČÜŅŗ | ½Ļ³¤Ź±¼äŗ󣬳Įµķ±äĪŖČé°×É« |
£Ø1£©¢ńÖŠµÄ°×É«³ĮµķŹĒ ”£
£Ø2£©¢ņÖŠÄÜĖµĆ÷³Įµķ±äŗŚµÄµÄĄė×Ó·½³ĢŹ½ŹĒ £¬³Įµķ×Ŗ»ÆµÄÖ÷ŅŖŌŅņŹĒ ”£
£Ø3£©ĀĖ³ö²½Öč¢óÖŠČé°×É«³Įµķ£¬ĶĘ²āŗ¬ÓŠAgCl”£ÓĆÅØHNO3Čܽā£¬²śÉśŗģ×ŲÉ«ĘųĢ壬²æ·Ö³ĮµķĪ“ČÜ
½ā£¬¹żĀĖµĆµ½ĀĖŅŗXŗĶ°×É«³ĮµķY”£
¢”£®ĻņXÖŠµĪ¼ÓBa£ØNO3£©2ČÜŅŗ£¬²śÉś°×É«³Įµķ
¢¢£®ĻņYÖŠµĪ¼ÓKIČÜŅŗ£¬²śÉś»ĘÉ«³Įµķ
¢ŁÓÉ¢”ÅŠ¶Ļ£¬ĀĖŅŗXÖŠ±»¼ģ³öµÄĄė×ÓŹĒ ”£
¢ŚÓÉ¢””¢¢¢æÉČ·ČĻ²½Öč¢óÖŠČé°×É«³Įµķŗ¬ÓŠAgClŗĶĮķŅ»ÖÖ³Įµķ_____ _”£
£Ø4£©øĆѧɜĶعżČēĻĀ¶ŌÕÕŹµŃéČ·ČĻĮĖ²½Öč¢óÖŠ Čé°×É«³Įµķ²śÉśµÄŌŅņ£ŗŌŚNaCl“ęŌŚĻĀ£¬ŃõĘų½«¢óÖŠŗŚÉ«³ĮµķŃõ»Æ”£

ĻÖ Ļó | B£ŗŅ»¶ĪŹ±¼äŗ󣬳öĻÖČé°×É«³Įµķ |
C£ŗŅ»¶ĪŹ±¼äŗó£¬ĪŽĆ÷ĻŌ±ä»Æ |
¢ŁAÖŠ²śÉśµÄĘųĢåŹĒ_________”£
¢ŚCÖŠŹ¢·ÅµÄĪļÖŹWŹĒ_________”£
¢ŪøĆĶ¬Ń§ČĻĪŖBÖŠ²śÉś³ĮµķµÄ·“Ó¦ČēĻĀ£ØĒė²¹³äĶźÕū£©£ŗ
2Ag2S + ![]() +
+ ![]() + 2H2O
+ 2H2O ![]() 4AgCl +
4AgCl + ![]() + 4NaOH
+ 4NaOH
¢Ü“ÓĘ½ŗāŅĘ¶ÆµÄ½Ē¶Č£¬½āŹĶBÖŠNaClµÄ×÷ÓĆ£ŗ ”£
”¾“š°ø”æ£Ø1£©AgCl
£Ø2£©2AgCl£Øs£©+ S2-![]() Ag2S£Øs£©+ 2Cl- £»Ag2S±ČAgClČܽā¶ČøüŠ”£Ø»ņAg2SµÄKspøüŠ”£©
Ag2S£Øs£©+ 2Cl- £»Ag2S±ČAgClČܽā¶ČøüŠ”£Ø»ņAg2SµÄKspøüŠ”£©
£Ø3£©¢Ł SO42-£»¢Ś S
£Ø4£©¢Ł O2 £»¢Ś Ag2S µÄŠü×ĒŅŗ
¢Ū![]()
¢Ü O2 ½«Ag2S Ńõ»ÆÉś³ÉSŹ±ÓŠAg+ÓĪĄė³öĄ“£¬NaClÖŠ“óĮæµÄCl-ÓėÓĪĄėµÄAg+½įŗĻ³ÉAgCl³Įµķ”£ÓÉÓŚc£ØAg+£©¼õŠ”£¬ÓŠĄūÓŚ¢ŪÖŠ·“Ó¦Ę½ŗāÓŅŅĘ£¬BÖŠ×īÖÕ³öĻÖČé°×É«³Įµķ
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©¢ńÖŠNaClÓėAgNO3ČÜŅŗ»ģŗĻ·¢Éś·“Ó¦£ŗAg++Cl-=AgCl”ż£¬ĖłŅŌ°×É«³ĮµķŹĒAgCl”£
¹Ź“š°øĪŖ£ŗAgCl£»
£Ø2£©Ė®ÖŠ“ęŌŚAgCl£Øs£©![]() Ag+£Øaq£©+Cl-£Øaq£©£¬ĻņĖłµĆ¹ĢŅŗ»ģŗĻĪļÖŠ¼ÓNa2SČÜŅŗÓÉÓŚS2-ÓėAg+Éś³ÉAg2SŹ¹ÉĻŹöĘ½ŗāÕżĻņŅĘ¶Æ£¬×īÖÕ°×É«³Įµķ±äŗŚ£¬øĆ·“Ó¦Ąė×Ó·½³ĢŹ½ŹĒ£ŗ2AgCl£Øs£©+ S2-
Ag+£Øaq£©+Cl-£Øaq£©£¬ĻņĖłµĆ¹ĢŅŗ»ģŗĻĪļÖŠ¼ÓNa2SČÜŅŗÓÉÓŚS2-ÓėAg+Éś³ÉAg2SŹ¹ÉĻŹöĘ½ŗāÕżĻņŅĘ¶Æ£¬×īÖÕ°×É«³Įµķ±äŗŚ£¬øĆ·“Ó¦Ąė×Ó·½³ĢŹ½ŹĒ£ŗ2AgCl£Øs£©+ S2-![]() Ag2S£Øs£©+ 2Cl- ”£³Įµķ×Ŗ»ÆµÄÖ÷ŅŖŌŅņŹĒ£ŗAg2S±ČAgClČܽā¶ČøüŠ”£Ø»ņAg2SµÄKspøüŠ”£©”£
Ag2S£Øs£©+ 2Cl- ”£³Įµķ×Ŗ»ÆµÄÖ÷ŅŖŌŅņŹĒ£ŗAg2S±ČAgClČܽā¶ČøüŠ”£Ø»ņAg2SµÄKspøüŠ”£©”£
¹Ź“š°øĪŖ£ŗ2AgCl£Øs£©+ S2-![]() Ag2S£Øs£©+ 2Cl-£»Ag2S±ČAgClČܽā¶ČøüŠ”£Ø»ņAg2SµÄKspøüŠ”£©£»
Ag2S£Øs£©+ 2Cl-£»Ag2S±ČAgClČܽā¶ČøüŠ”£Ø»ņAg2SµÄKspøüŠ”£©£»
£Ø3£©ĀĖ³öŗŚÉ«³Įµķ¼ÓČėNaClČÜŅŗ£¬½Ļ³¤Ź±¼äŗ󣬳Įµķ±äĪŖČé°×É«”£ĀĖ³ö²½Öč¢óÖŠČé°×É«³Įµķ£¬ÓĆÅØHNO3Čܽā£¬²śÉśŗģ×ŲÉ«ĘųĢ壬²æ·Ö³ĮµķĪ“Čܽā£¬¹żĀĖµĆµ½ĀĖŅŗXŗĶ°×É«³ĮµķY”£ĻņXÖŠµĪ¼ÓBa£ØNO3£©2ČÜŅŗ²śÉś°×É«³Įµķ£¬ĖµĆ÷XÖŠŗ¬ÓŠSO42-£»ĻņYÖŠµĪ¼ÓKIČÜŅŗ£¬²śÉś»ĘÉ«³Įµķ£¬ĖµĆ÷°×É«³ĮµķYĪŖAgCl£»æɽųŅ»²½Č·¶ØČé°×É«³Įµķŗ¬ÓŠAgClŗĶµ„ÖŹS”£
¹Ź“š°øĪŖ£ŗSO42-£»S£»
£Ø4£©øĆѧɜµÄŹµŃéÄæµÄŹĒĶعż¶ŌÕÕŹµŃéČ·ČĻĮĖ²½Öč¢óÖŠ Čé°×É«³Įµķ²śÉśµÄŌŅņ£ŗŌŚNaCl“ęŌŚĻĀ£¬ŃõĘų½«¢óÖŠŗŚÉ«³ĮµķŃõ»Æ”£ĖłŅŌ¢ŁŌŚMnO2×ö“߻ƼĮĢõ¼žĻĀH2O2·¢Éś·Ö½ā·“Ӧɜ³ÉO2£¬¼“AÖŠ²śÉśµÄĘųĢåŹĒO2£»¢ŚCÖŠŹ¢·ÅµÄĪļÖŹWŹĒAg2S µÄŠü×ĒŅŗ£»¢Ū BÖŠ²śÉś³ĮµķµÄ·“Ó¦ĪŖ£ŗ2Ag2S+O2+4NaCl+2H2O ![]() 4AgCl+2S+4NaOH”£BÖŠNaClµÄ×÷ÓĆ£ŗO2 ½«Ag2S Ńõ»ÆÉś³ÉSŹ±ÓŠAg+ÓĪĄė³öĄ“£¬NaClÖŠ“óĮæµÄCl-ÓėÓĪĄėµÄAg+½įŗĻ³ÉAgCl³Įµķ”£ÓÉÓŚc£ØAg+£©¼õŠ”£¬ÓŠĄūÓŚ¢ŪÖŠ·“Ó¦Ę½ŗāÓŅŅĘ£¬BÖŠ×īÖÕ³öĻÖČé°×É«³Įµķ”£
4AgCl+2S+4NaOH”£BÖŠNaClµÄ×÷ÓĆ£ŗO2 ½«Ag2S Ńõ»ÆÉś³ÉSŹ±ÓŠAg+ÓĪĄė³öĄ“£¬NaClÖŠ“óĮæµÄCl-ÓėÓĪĄėµÄAg+½įŗĻ³ÉAgCl³Įµķ”£ÓÉÓŚc£ØAg+£©¼õŠ”£¬ÓŠĄūÓŚ¢ŪÖŠ·“Ó¦Ę½ŗāÓŅŅĘ£¬BÖŠ×īÖÕ³öĻÖČé°×É«³Įµķ”£
¹Ź“š°øĪŖ£ŗ¢Ł O2 £»¢Ś Ag2S µÄŠü×ĒŅŗ£»¢Ū2Ag2S+O2+4NaCl+2H2O ![]() 4AgCl+2S+4NaOH£»¢ÜO2½«Ag2S Ńõ»ÆÉś³ÉSŹ±ÓŠAg+ÓĪĄė³öĄ“£¬NaClÖŠ“óĮæµÄCl-ÓėÓĪĄėµÄAg+½įŗĻ³ÉAgCl³Įµķ”£ÓÉÓŚc£ØAg+£©¼õŠ”£¬ÓŠĄūÓŚ¢ŪÖŠ·“Ó¦Ę½ŗāÓŅŅĘ£¬BÖŠ×īÖÕ³öĻÖČé°×É«³Įµķ”£
4AgCl+2S+4NaOH£»¢ÜO2½«Ag2S Ńõ»ÆÉś³ÉSŹ±ÓŠAg+ÓĪĄė³öĄ“£¬NaClÖŠ“óĮæµÄCl-ÓėÓĪĄėµÄAg+½įŗĻ³ÉAgCl³Įµķ”£ÓÉÓŚc£ØAg+£©¼õŠ”£¬ÓŠĄūÓŚ¢ŪÖŠ·“Ó¦Ę½ŗāÓŅŅĘ£¬BÖŠ×īÖÕ³öĻÖČé°×É«³Įµķ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦£ŗ2SO2(g)£«O2(g)![]() 2SO3(g) ¦¤H<0”£Ä³ĪĀ¶ČĻĀ£¬½«2 mol SO2ŗĶ1 mol O2ÖĆÓŚ10 LĆܱÕČŻĘ÷ÖŠ£¬·“Ó¦“ļµ½Ę½ŗāŗó£¬SO2µÄĘ½ŗā×Ŗ»ÆĀŹ(¦Į)ÓėĢåĻµ×ÜŃ¹Ēæ(p)µÄ¹ŲĻµČēĶ¼¼×ĖłŹ¾”£
2SO3(g) ¦¤H<0”£Ä³ĪĀ¶ČĻĀ£¬½«2 mol SO2ŗĶ1 mol O2ÖĆÓŚ10 LĆܱÕČŻĘ÷ÖŠ£¬·“Ó¦“ļµ½Ę½ŗāŗó£¬SO2µÄĘ½ŗā×Ŗ»ÆĀŹ(¦Į)ÓėĢåĻµ×ÜŃ¹Ēæ(p)µÄ¹ŲĻµČēĶ¼¼×ĖłŹ¾”£

ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®ÓÉĶ¼¼×ÖŖ£¬AµćSO2µÄĘ½ŗāÅضČĪŖ0.4 mol”¤L£1
B£®ÓÉĶ¼¼×ÖŖ£¬BµćSO2”¢O2”¢SO3µÄĘ½ŗāÅضČÖ®±ČĪŖ2:1:2
C£®“ļĘ½ŗāŗó£¬ĖõŠ”ČŻĘ÷ČŻ»ż£¬Ōņ·“Ó¦ĖŁĀŹ±ä»ÆĶ¼ĻóæÉŅŌÓĆĶ¼ŅŅ±ķŹ¾
D£®Ń¹ĒæĪŖ0.50 MPaŹ±£¬²»Ķ¬ĪĀ¶ČĻĀSO2×Ŗ»ÆĀŹÓėĪĀ¶Č¹ŲĻµČē±ūĶ¼£¬ŌņT2£¾T1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Æѧ·“Ó¦ŌĄķŃŠ¾æµŖ”¢ŃõµČµ„ÖŹ¼°Ęä»ÆŗĻĪļµÄ·“Ó¦ÓŠÖŲŅŖŅāŅ唣
£Ø1£©ŗĻ³É°±·“Ó¦N2(g)+3H2(g)![]() 2NH3(g)£¬ČōŌŚŗćĪĀ”¢ŗćŃ¹Ģõ¼žĻĀĻņĘ½ŗāĢåĻµÖŠĶØČėė²Ęų£¬Ę½ŗā ŅĘ¶Æ£ØĢī”°Ļņ×ó”±”¢”°ĻņÓŅ”±”¢»ņ”°²»”±£©”£
2NH3(g)£¬ČōŌŚŗćĪĀ”¢ŗćŃ¹Ģõ¼žĻĀĻņĘ½ŗāĢåĻµÖŠĶØČėė²Ęų£¬Ę½ŗā ŅĘ¶Æ£ØĢī”°Ļņ×ó”±”¢”°ĻņÓŅ”±”¢»ņ”°²»”±£©”£
£Ø2£©O2 (g)£½O+2(g)+e- ![]() H1=+ 1175.7 kJ”¤mol-1
H1=+ 1175.7 kJ”¤mol-1
PtF6(g)+ e- ![]() PtF6-(g)
PtF6-(g) ![]() H2= - 771.1 kJ”¤mol-1
H2= - 771.1 kJ”¤mol-1
O2+PtF6-(s)£½O2+(g)+PtF6- ![]() H3=+482.2 kJ”¤mol-1
H3=+482.2 kJ”¤mol-1
Ōņ·“Ó¦O2£Øg£©+ PtF6 (g)£½O2++PtF6- (s)µÄ![]() H£½_____________ kJ”¤mol-1”£
H£½_____________ kJ”¤mol-1”£
£Ø3£©ŌŚ25”ęĻĀ£¬ĻņÅØ¶Č¾łĪŖ0.1 mol”¤L-1µÄMgCl2ŗĶCuCl2»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓČė°±Ė®£¬ĻČÉś³É___³Įµķ£ØĢī»ÆѧŹ½£©£¬Éś³ÉøĆ³ĮµķµÄĄė×Ó·½³ĢŹ½ĪŖ_________”££ØŅŃÖŖ25”ꏱ£¬Ksp[Mg(OH)2]£½1.8”Į10-11£¬Ksp[Cu(OH)2]£½2.2”Į10-20£©
£Ø4£©ŌŚ25”ęĻĀ£¬½«a mol”¤L-1µÄ°±Ė®Óė0.01 mol”¤L-1µÄŃĪĖįµČĢå»ż»ģŗĻ£¬·“Ó¦Ę½ŗāŹ±ČÜŅŗÖŠc(NH4+)£½c(Cl-)£¬ŌņČÜŅŗĻŌ_____________ŠŌ£ØĢī”°Ėį”±”¢”°¼ī”±”¢»ņ”°ÖŠ”±£©£»ÓĆŗ¬aµÄ“śŹżŹ½±ķŹ¾NH3”¤H2OµÄµēĄė³£ŹżKb£½__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬Ģå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬NO2ŗĶN2O4Ö®¼ä·¢Éś·“Ó¦£ŗ
2NO2£Øg£©£Øŗģ×ŲÉ«£©![]() N2O4£Øg£©£ØĪŽÉ«£©£¬ČēĶ¼ĖłŹ¾£®
N2O4£Øg£©£ØĪŽÉ«£©£¬ČēĶ¼ĖłŹ¾£®

£Ø1£©ĒśĻß £ØĢī”°X”±»ņ”°Y”±£©±ķŹ¾NO2µÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻߣ®
£Ø2£©Čō½µµĶĪĀ¶Č£¬Ōņv£ØÄę£© £®£ØĢī”°¼Óæģ”±»ņ”°¼õĀż”±»ņ”°²»±ä”±£©£®
£Ø3£©ČōÉĻŹö·“Ó¦ŌŚ¼×”¢ŅŅĮ½øöĻąĶ¬ČŻĘ÷ÄŚĶ¬Ź±½ųŠŠ£¬·Ö±š²āµĆ¼×ÖŠv£ØNO2£©=0.3mol/£ØLs£©£¬ŅŅÖŠv£ØN2O4£©=6mol/£ØLmin£©£¬Ōņ ÖŠ·“Ó¦øüæģ£®
£Ø4£©ĻĀĮŠŠšŹöÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ£ØĢī±źŗÅ£© £»
A£®v£ØNO2£©=2v£ØN2O4£©
B£®ČŻĘ÷ÄŚŃ¹Ēæ²»ŌŁ·¢Éś±ä»Æ
C£®XµÄĢå»ż·ÖŹż²»ŌŁ·¢Éś±ä»Æ
D£®ČŻĘ÷ÄŚĘųĢåŌ×Ó×ÜŹż²»ŌŁ·¢Éś±ä»Æ
E£®ĻąĶ¬Ź±¼äÄŚĻūŗÄn molµÄYµÄĶ¬Ź±Éś³É2n molµÄX
F£®ĻąĶ¬Ź±¼äÄŚĻūŗÄn molµÄYµÄĶ¬Ź±ĻūŗÄ2n molµÄX£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNA ĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®0.1molµÄ°×Į×(P4)»ņCCl4ÖŠĖłŗ¬µÄ¹²¼Ū¼üŹż¾łĪŖ0.4NA
B£®S2ŗĶS8µÄ»ģŗĻĪļ¹²6.4g£¬ĘäÖŠĖłŗ¬µÄµē×ÓŹżŅ»¶ØĪŖ3.2NA
C£®5.4gAl·Ö±šÓŚŗ¬ČÜÖŹ0.2molµÄNaOHČÜŅŗ”¢ŃĪĖį·“Ó¦£¬Éś³ÉH2·Ö×ÓŹż¾łĪŖ0.3NA
D£®ŌŚH2O2+Cl2=2HCl+O2·“Ó¦ÖŠ£¬ĆæÉś³É32gO2£¬×ŖŅĘ4 NAøöµē×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠČēĻĀ·“Ó¦£ŗA£Øg£©+2B£Øg£©![]() 3C£Øg£©+nD£Øg£©£¬æŖŹ¼Ź±AĪŖ4mol£¬BĪŖ6mol£»5minÄ©Ź±²āµĆCµÄĪļÖŹµÄĮæĪŖ3mol£¬ÓĆD±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹv£ØD£©ĪŖ0.2mol/£ØL”¤min£©”£¼ĘĖć
3C£Øg£©+nD£Øg£©£¬æŖŹ¼Ź±AĪŖ4mol£¬BĪŖ6mol£»5minÄ©Ź±²āµĆCµÄĪļÖŹµÄĮæĪŖ3mol£¬ÓĆD±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹv£ØD£©ĪŖ0.2mol/£ØL”¤min£©”£¼ĘĖć
£Ø1£©5minÄ©AµÄĪļÖŹµÄĮæÅضČĪŖ__________”£
£Ø2£©Ē°5minÄŚÓĆB±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹv£ØB£©ĪŖ___________”£
£Ø3£©»Æѧ·½³ĢŹ½ÖŠnÖµĪŖ__________”£
£Ø4£©“Ė·“Ó¦ŌŚĖÄÖÖ²»Ķ¬ĒéæöĻĀµÄ·“Ó¦ĖŁĀŹ·Ö±šĪŖ£ŗ
¢Łv£ØA£©=5mol/£ØL”¤min£© ¢Śv£ØB£©=6mol/£ØL”¤min£©
¢Ūv£ØC£©=4.5mol/£ØL”¤min£© ¢Üv£ØD£©=8mol/£ØL”¤min£©
ĘäÖŠ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ__________£ØĢī±ąŗÅ£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[»Æѧ”Ŗ”ŖŃ”ŠŽ3£ŗĪļÖŹ½į¹¹ÓėŠŌÖŹ]
ÕÅĶ¤¶°ŃŠ¾æŠ”×éŹÜĆń¼äÖŠŅ½Ęō·¢£¬·¢ĻÖAs2O3£ØĖ׳ĘÅųĖŖ£©¶Ō°×ŃŖ²”ÓŠĆ÷ĻŌµÄÖĪĮĘ×÷ÓĆ£®µŖ£ØN£©”¢Į×£ØP£©”¢Éé£ØAs£©µČ¶¼ŹĒVA×åµÄŌŖĖŲ£¬øĆ×åŌŖĖŲµÄ»ÆŗĻĪļŌŚŃŠ¾æŗĶÉś²śÖŠÓŠŠķ¶ąÖŲŅŖÓĆĶ¾£®»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AsŌ×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ ”£
£Ø2£©PŗĶSŹĒĶ¬Ņ»ÖÜĘŚµÄĮ½ÖÖŌŖĖŲ£¬PµÄµŚŅ»µēĄėÄܱČS“ó£¬ŌŅņŹĒ ”£
£Ø3£©NH4+ÖŠH©N©HµÄ¼ü½Ē±ČNH3ÖŠH©N©HµÄ¼ü½Ē £ØĢī”°“ó”±»ņ”°Š””±£©£¬ŌŅņŹĒ ”£
£Ø4£©Na3AsO4ÖŠŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶ°üĄØ £»AsO43©µÄæռ乹ŠĶĪŖ £¬As4O6µÄ·Ö×Ó½į¹¹ČēĶ¼1ĖłŹ¾£¬ŌņŌŚøĆ»ÆŗĻĪļÖŠAsµÄŌӻƷ½Ź½ŹĒ ”£
£Ø5£©»ÆŗĻĪļNH5ÖŠµÄĖłÓŠŌ×Ó×īĶā²ć¶¼Āś×ćĪČ¶Ø½į¹¹£¬ŌņNH5ŹĒ ¾§Ģ壮
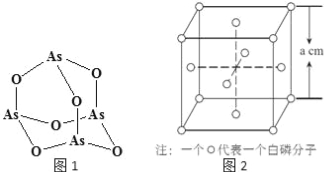
£Ø6£©°×Į×£ØP4£©µÄ¾§ĢåŹōÓŚ·Ö×Ó¾§Ģ壬Ę侧°ū½į¹¹ČēĶ¼2£ØŠ”Ō²Č¦±ķŹ¾°×Į×·Ö×Ó£©£®¼ŗÖŖ¾§°ūµÄ±ß³¤ĪŖa cm£¬°¢·ü¼ÓµĀĀŽ³£ŹżĪŖNA mol©l£¬ŌņøĆ¾§°ūÖŠŗ¬ÓŠµÄPŌ×ÓµÄøöŹżĪŖ £¬øĆ¾§ĢåµÄĆܶČĪŖ gcm©3£ØÓĆŗ¬NA”¢aµÄŹ½×Ó±ķŹ¾£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[»Æѧ”Ŗ”ŖŃ”ŠŽ5£ŗÓŠ»ś»Æѧ»ł“”]
±½·ÓŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ”£ŅŌ±½·ÓĪŖÖ÷ŅŖĘšŹ¼ŌĮĻ£¬Ä³ÖÖŅ©ĪļÖŠ¼äĢåµÄŗĻ³ÉĀ·ĻßČēĻĀ£ŗ

ŅŃÖŖ£ŗ![]()
£Ø1£©CÖŠŗ¬Ńõ¹ŁÄÜĶŵÄĆū³ĘĪŖ £»
£Ø2£©·“Ó¦IµÄ·“Ó¦ĄąŠĶŹĒ £»
£Ø3£©·“Ó¦¢ņµÄ»Æѧ·½³ĢŹ½ĪŖ £»
£Ø4£©»ÆŗĻĪļBµÄĆū³ĘŹĒ £¬EµÄ½į¹¹¼ņŹ½ĪŖ £»
£Ø5£©Š“³öĀś×ćĻĀĮŠĢõ¼žµÄFµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ £ØČĪŠ“Į½ÖÖ£©”£
![]() ¢Ł±½»·ÉĻÓŠČżøöČ”“ś»łĒŅ±½»·ÉĻµÄŅ»ĀČČ”“śĪļÖ»ÓŠĮ½ÖÖ.¢ŚÄÜÓėFeCl3ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦.¢ŪŗģĶā¹āĘ×ĻŌŹ¾ÓŠ
¢Ł±½»·ÉĻÓŠČżøöČ”“ś»łĒŅ±½»·ÉĻµÄŅ»ĀČČ”“śĪļÖ»ÓŠĮ½ÖÖ.¢ŚÄÜÓėFeCl3ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦.¢ŪŗģĶā¹āĘ×ĻŌŹ¾ÓŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆŗĻĪļA×īŌē·¢ĻÖÓŚĖįÅ£ÄĢÖŠ£¬ĖüŹĒČĖĢåÄŚĢĒ“śŠ»µÄÖŠ¼äĢ壬æÉÓÉĀķĮåŹķ”¢ÓńĆ×µķ·ŪµČ·¢½ĶÖʵƔ£AµÄøĘŃĪŹĒČĖĆĒĻ²°®µÄ²¹øĘ¼ĮÖ®Ņ»”£AŌŚÄ³Ö֓߻ƼĮ“ęŌŚĻĀ½ųŠŠŃõ»Æ£¬Ęä²śĪļ²»ÄÜ·¢ÉśŅų¾µ·“Ó¦”£ŌŚÅØĮņĖį“ęŌŚĻĀ£¬AæÉ·¢ÉśČēĻĀĶ¼ĖłŹ¾µÄ·“Ó¦£ŗ

£Ø1£©ŹŌŠ“³ö»ÆŗĻĪļµÄ½į¹¹¼ņŹ½£ŗA_____________£¬E_____________£¬F_____________”£
£Ø2£©»Æѧ·½³ĢŹ½£ŗA”śB:______________________________________£¬
£Ø3£©ĖÄøö·“Ó¦ÖŠ£¬²»ŹōÓŚõ„»Æ·“Ó¦µÄŹĒ£ŗA”ś_________(Ģī»ÆŗĻĪļ¶ŌÓ¦µÄ×ÖÄø)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com