
下列叙述正确的是( )
| A.P4和NO2都是共价化合物 |
| B.CCl4和NH3都是以极性键结合的极性分子 |
| C.在CaO和SiO2晶体中,都不存在单个小分子 |
| D.在冰(固态水)中,既有极性键、非极性键,又有氢键 |
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:单选题
下列说法中不正确的是
| A.σ键比π键电子云重叠程度大,一般比较牢固 |
| B.两个原子之间形成共价键时,最多有一个σ键 |
| C.在气体单质中,一定有σ键,可能有π键 |
| D.乙烯分子中有5个σ键,1个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A.分子中三个碳原子可能处于同一直线上
B.全氟丙烷的电子式为: 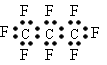
C.全氟丙烷与全氟乙烯互为同系物
D.全氟丙烷分子中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下面叙述正确的是 ( )
| A.共价化合物中没有离子键 |
| B.离子化合物中没有共价键 |
| C.正四面体构型的分子,键角均为109°28' |
| D.直线型分子中的键角均为180° |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有如下各说法:( )
①在水分子中氢、氧原子间以共价键相结合;
②活泼金属和活泼非金属化合时一般形成离子键;
③非金属元素间形成的化合物一定是共价化合物;
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键;
⑤冰的密度比水的密度小,这与氢键有关;
上述各种说法正确的是
| A.①②⑤ | B.①②④⑤ | C.①②③④⑤ | D.①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,氨气和氟气发生反应:4NH3 + 3F2 → NF3 + 3NH4F,其中产物NF3分子结构和NH3相似。下列有关说法错误的是
| A.NF3分子呈三角锥形 |
| B.NF3分子是极性分子 |
| C.NF3与NH3晶体类型相同 |
| D.上述反应中,反应物和生成物均属于共价分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.非金属元素原子组成的化合物不可能是离子化合物 |
| B.ⅠA族元素的金属性不一定比ⅡA族元素的金属性强 |
| C.同一主族元素组成的化合物一定是共价化合物 |
| D.通过化学变化可以实现18O与16O间的相互转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com