
| A. | ①⑤ | B. | ③④ | C. | ② | D. | 全都不行 |
分析 ①铜离子为有色离子,不满足溶液无色的条件;
②pH=11的溶液中存在大量氢氧根离子,碳酸氢根离子与氢氧根离子反应;
③能使酚酞试剂变红的溶液中存在大量氢氧根离子,铵根离子与氢氧根离子反应;
④稀HCl溶液中,硫离子与氢离子反应;
⑤能使石蕊试纸变为红色的溶液中存在大量氢离子,亚硫酸根离子与镁离子、氢离子反应.
解答 解:①无色溶液中不存在有色的Cu2+离子,故①错误;
②pH=11的溶液呈碱性,溶液中存在大量氢氧根离子,Ba2+、HCO3-与氢氧根离子反应生成碳酸钡沉淀,在溶液中不能大量共存,故②错误;
③能使酚酞试剂变红的溶液呈碱性,溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应,在溶液中不能大量共存,故③错误;
④稀HCl溶液中,S2-与氢离子反应,在溶液中不能大量共存,故④错误;
⑤能使石蕊试纸变为红色的溶液呈酸性,溶液中存在大量氢离子,SO32-与Mg2+、H+反应,在溶液中不能大量共存,故⑤错误;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
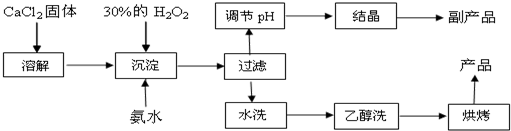
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
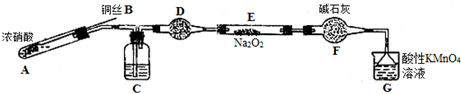
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
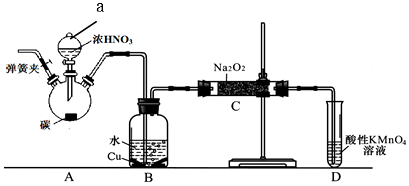
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
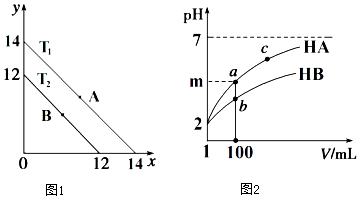 (1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.
(1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是浓氨水 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO固体(Al2O3) | B. | Na2CO3固体(NaHCO3) | ||
| C. | FeCl2溶液(CuCl2) | D. | Fe2O3固体(SiO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com