
| A、该反应属于熵增放热反应,一定能自发进行 |
| B、5 min内H2的平均反应速率为0.1 mol/(L?min) |
| C、其它条件不变的情况下,加入催化剂可提高CO的转化率 |
| D、若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4 |
| 1mol/L |
| 5min |
| 0.5 |
| 0.5×1.42 |
| 25 |
| 49 |
| 2 |
| 2×y2 |
| 25 |
| 49 |


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
| A、Na2CO3?2Na++CO32- |
| B、H2CO3?2H++CO32- |
| C、NH3?H2O?NH3+H2O |
| D、H2SO3?H++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、950mL,111.2g |
| B、500mL,117g |
| C、1000mL,117g |
| D、任意规格,111.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
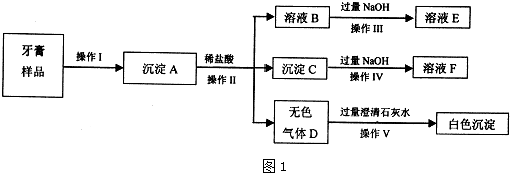

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的加成反应和乙烯使酸性KMnO4溶液褪色,都与分子内含有的碳碳双键有关 |
| B、用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 |
| C、乙烯的化学性质比乙烷活泼 |
| D、相同质量的乙烯和甲烷完全燃烧后生成水的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 s内X的平均反应速率为0.01 mol?L-1?s-1 |
| B、升高温度,若X的体积分数减小,则正反应的△H<0 |
| C、将容器的容积变为20 L,达平衡后Z的浓度为0.015 mol?L-1 |
| D、保持温度和体积不变,若再充入1 mol X,Y的转化率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鱼肝油 | B、水果 |
| C、动物肝脏 | D、豆制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )| A、a电极是阴极 |
| B、电解过程中水是氧化剂 |
| C、a电极附近溶液的pH变小 |
| D、b极电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com