
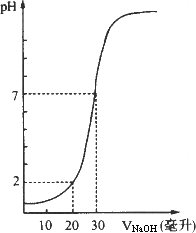
下图为10.00 mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH(aq)Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度正确的是( )
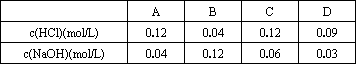
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:阅读理解
某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
Ⅰ.测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,其反应的离子方程式为:
4![]() +5HCHO+12H+====4Mn2++5CO2↑+11H2O
+5HCHO+12H+====4Mn2++5CO2↑+11H2O
2![]() +5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
Ⅱ.测定装置:部分装置如下图所示(a、b为止水夹)

Ⅲ.实验步骤:
①检查装置气密性(气密性良好)。
②用A仪器准确移取25.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6 mol·L-1 H2SO4溶液备用。
③将2.00×10-3 mol·L-1的草酸标准溶液置于A仪器中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入高锰酸钾酸性溶液中,使其充分反应。再如此重复4次(共5次)。
⑤将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2—3次,并将洗涤液全部转入锥形瓶)。
⑥用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液体积。
⑦再重复实验2次。
Ⅳ.数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为25.00 mL):
装修后第n天 | 草酸溶液/mL | 甲醛的浓度/mg·m-3 | |||
1 | 2 | 3 | 平均值 | ||
1 | 15.86 | 15.72 | 15.67 | 15.75 |
|
7 | 26.24 | 26.36 | 26.31 | 26.30 |
|
30 | 30.90 | 30.67 | 30.81 | 30.79 |
|
请完成下列问题:
(1)A仪器名称是_________________ 。
(2)步骤④如果压送气体时速度过快,可能会产生什么不利后果?
_____________________________________________________________________。
(3)步骤⑤如果没有润洗,所测甲醛的含量将____________(填“偏高”“偏低”或“无影响”)。
(4)本实验是否需要指示剂(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象):___________________________________________________________________。
(5)假设KMnO4溶液的物质的量浓度为c1 mol·L-1,所取KMnO4溶液的体积为V1 mL;草酸溶液的物质的量浓度为c2 mol·L-1,消耗草酸溶液的平均体积为V2 mL。
则:计算室内空气中甲醛浓度(mg·m-3)的代数式为____________,第30天室内空气中甲醛浓度为____________,并判断此时主人____________(填“能”或“否”)入住。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为:4![]() +5HCHO+H+
+5HCHO+H+![]() 4Mn2++5CO2↑+11H2O
4Mn2++5CO2↑+11H2O
2![]() +5H
+5H![]() 2Mn2++10CO2 ↑+8H2O
2Mn2++10CO2 ↑+8H2O
测定装置:部分装置如下图所示(a、b为止水夹)

测定步骤:
①收集待检新装修的房屋居室空气
②准确量取5.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液于250 mL锥形瓶中,滴入3滴6 mol·L-1的H2SO4溶液,加水45 mL稀释备用。
③将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入高锰酸钾酸性溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
完成以下问题:
(1)使用________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?
___________________________。
(3)本实验是否需要外加指示剂?若需要,请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
___________________________。
(4)计算该居室内空气中甲醛的浓度_________mg·m-3,该居室的甲醛_________(填“是”或“否”)超标。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2010年浙江省温州二中高二第二学期期中考试化学试题 题型:实验题
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)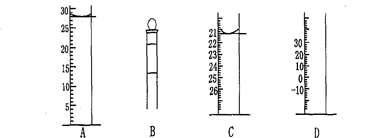
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 | |
| B.用待测定的溶液润洗酸式滴定管。 | C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
 Mg2+ +2OH-
Mg2+ +2OH-查看答案和解析>>
科目:高中化学 来源:2010年浙江省高二第二学期期中考试化学试题 题型:实验题
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)

图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2  Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com