
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.78g Na2O2溶于水后所得溶液中含有O22-数目为2NA
B.将2.24 LCl2(标况)通入到足量的NaOH溶液中,转移的电子数目为0.1NA
C.0.1 mol/LNH4Cl溶液中含有的NH4+数目小于0.1NA
D.用铅蓄电池电解氯化钠溶液,得到1 molH2时,理论上铅蓄电池中消耗氢离子数目为2NA
【答案】B
【解析】
A. 78 g过氧化钠的物质的量为1 mol,过氧化钠与水反应后生成氢氧化钠和氧气,溶液中不存在过氧根离子,A错误;
B. 2.24 LCl2(标况)的物质的量n(Cl2)=![]() =0.1 mol,而氯气和碱的反应为歧化反应,氯元素歧化为-1和+1,故0.1 mol氯气转移0.1NA个电子,B正确;
=0.1 mol,而氯气和碱的反应为歧化反应,氯元素歧化为-1和+1,故0.1 mol氯气转移0.1NA个电子,B正确;
C. 0.1 mol/LNH4Cl溶液体积不知,不能计算溶质微粒的物质的量及微粒数,C错误;
D.以铅蓄电池电解NaC1溶液得到1 molH2(标况),转移电子的物质的量为2 mol,铅蓄电池的正极电极反应式为PbO2+2e-+4H+=PbSO4+2H2O,可知消耗4 mol的氢离子,所以理论上铅蓄电池中耗氢离子个数为4NA,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】科学的发展、社会的进步和生活水平的提高都离不开化学的发展和各种材料的开发制造。
(1)中国高铁发展迅速,高铁建设使用的主要材料有钢铁、铝合金和玻璃等。
①高炉炼铁和制造普通玻璃都要用到的原料是________;高温下将铁矿石还原为金属铁的还原剂是________。
②钢铁、铝合金、玻璃都属于________(填字母)。
a.混合物 b.化合物 c.单质
(2)生活环境的改善,需要对生活和生产中的废弃物进行处理。
①燃煤排放的二氧化硫会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是______________________________________(用化学方程式表示)。
②氮肥和硝酸的工业生产以及汽车等交通工具的使用,会有大量的氮氧化物(主要是![]() 和
和![]() )排放到空气中,这些氮氧化物对环境造成的影响有________(填一种即可)。氮氧化物可用氢氧化钠溶液吸收转化为
)排放到空气中,这些氮氧化物对环境造成的影响有________(填一种即可)。氮氧化物可用氢氧化钠溶液吸收转化为![]() 、________和
、________和![]() 。汽车安装尾气催化转化装置,可将尾气中的氮氧化物和一氧化碳转化为
。汽车安装尾气催化转化装置,可将尾气中的氮氧化物和一氧化碳转化为![]() 和________。
和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4molA 气体和 2molB 气体在 2L 的容器中混合,在一定条件下发生如下反应:2A(g) +B(g) 2C(g),若经 2s 后达到平衡,测得 C 的浓度为 0.6mol·L-1,现有下列几种说法:①用物质 A 的浓度变化表示的反应速率为 0.3mol·L -1·s -1,②用物质 B 的浓度变化表示的反应速率为0.6 mol·L-1·s -1,③平衡时物质A 的转化率为70%,④平衡时物质B 的浓度为0.7mol·L-1,其中正确的是( )
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是 ( )
A. 2.0 g D2O中含有的质子数、电子数均为NA
B. 室温下,7 g乙烯和丁烯的混合气体中所含的氢原子数目是NA
C. 室温下,2 L 0.05 mol·L-1 NH4NO3溶液中所含的氮原子数目是0.2NA
D. 256 g S8(分子结构如图 )含S—S键数目为7NA
)含S—S键数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,氨水中NH3·H2O的电离平衡常数:Kb≈1×10-5。向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是
与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是

A. NH4Cl的电离方程式为:NH4Cl![]() Cl-+NH4+
Cl-+NH4+
B. M点时,pH≈9
C. a=0.05
D. 当n(NaOH)=0.05 mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+CO2(g)![]() 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向逆方向进行的是
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向逆方向进行的是
A.升高温度和增大压强B.降低温度和减小压强
C.降低温度和增大压强D.升高温度和减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式___。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=___kJ·mol-1。
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
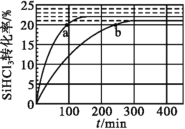
①343K时反应的平衡转化率α=___%。
②比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3;物质结构与性质]
明朝《天工开物》中有世界上最早的关于炼锌技术的记载,锌也是人体必需的微量元素。回答下列问题:
(1)基态Zn原子核外的最高能层符号是________,基态Zn2+最外层电子排布式为________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除Zn外其余元素的电负性由大到小排序为________。
②向[Zn(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是________。
③已知[Zn(NH3)4]2+的空间构型与![]() 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
④在[Zn(NH3)4]SO4晶体中存在的作用力有________。
A.离子键 B.极性共价键 C.氢键
D.配位键 E.范德华力 F.金属键
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是________________________________。
(4)常温下金属锌晶体的晶胞为六方最密堆积(如图所示),若锌原子的半径为rnm,六棱柱的高为![]() ,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
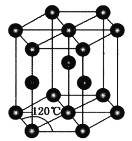
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由合成气制备二甲醚,涉及如下反应:
(i)2CH3OH(g)![]() C2H4(g)+2H2O(g) ΔH1
C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:
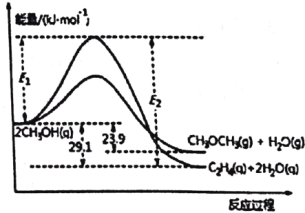
下列说法正确的是
A. ΔH1<ΔH2
B. 反应(ii)为吸热反应
C. C2H4(g)+H2O(g)![]() CH3OCH3(g) ΔH = -5.2 kJ·mol-1
CH3OCH3(g) ΔH = -5.2 kJ·mol-1
D. 若在容器中加入催化剂,则E2-E1将变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com