
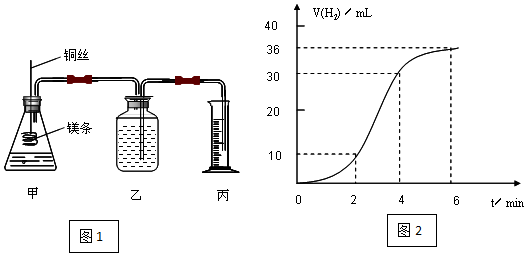
分析 (1)根据该反应的反应热效应及溶液中氢离子的浓度判断,反应速率加快是因为反应放热,温度升高,反应速率减慢是因为氢离子浓度降低;
(2)氯离子对反应可能的情况有:有促进作用、阻碍作用、无影响,由于铝与盐酸反应更快,则可提出硫酸根在反应中的猜想;
①原因Ⅰ:根据Cl-对反应没有影响,而SO42-对反应具有阻碍作用提出相反猜想;
原因Ⅴ:根据原因Ⅳ提出与原因Ⅴ相反的观点;
②要证明原因Ⅲ正确,则实验a反应反应速率加快,而在实验b中反应速率减慢.
解答 解:(1)镁与盐酸的反应是放热反应,随着反应的进行,放出的热量越多,溶液的温度越高,反应速率越大;随着反应的进行,溶液中氢离子的浓度逐渐减小,浓度越小,反应速率越小,
故答案为:镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小;
(2)原因Ⅱ:根据Cl-对反应没有影响,而SO42-对反应具有阻碍作用提出与原因Ⅰ相反的观点,
故答案为:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅴ根据原因Ⅳ结合题意,提出与原因Ⅳ相反的观点,
故答案为:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大(或SO42-影响更小);
②a中原来快有硫酸根离子,后加入氯离子,如果氯离子有促进作用,那么反应速率就比未加时快,以此证明原因Ⅲ是正确的;
b中原来快有氯离子,后加入硫酸根离子,如果硫酸根离子有阻碍作用,那么反应速率比未加时慢,以此说明因Ⅲ是正确的,
故答案为:反应速率加快; 反应速率减慢.
点评 本题考查外界条件对反应速率的影响,题目难度中等,明确对照试验的设计原则为解答关键,注意掌握影响化学反应速率的因素,试题培养了学生的分析能力及化学实验能力.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 电解由Y、Z组成的化合物可获得Z的单质 | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | 由X、Y组成的化合物只有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y 单质可以在海水中提取 | B. | 单质氧化性:Y>Z | ||
| C. | 气态氢化物稳定性:HX<HZ | D. | 离子半径:X->Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{106(m-n)}{11m}$×100% | B. | $\frac{168(m-n)}{56m}$×100% | C. | $\frac{84(n-m)?}{11m}$×100% | D. | $\frac{?(n-m)?}{m}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:W>X | |
| C. | 单质熔点:X>W>Y | |
| D. | q与p、r的化学键种类完全不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1 molNH3通入水中得到1L溶液,则NH4+与NH3•H2O粒子总数为NA | |
| B. | 1.2 g NaHSO4晶体中含有离子总数为0.03 NA | |
| C. | 标准状况下,2.24 L SO3含有的分子数为0.1 NA | |
| D. | 14 g乙烯和环丙烷(C3H6)混合气体中的碳原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物是麦芽糖 | |
| B. | 丙烯分子中三个碳原子处于同一直线上 | |
| C. | 二氯甲烷只有一种结构,可证明甲烷是正四面体构型 | |
| D. | 符合分子式为C4H10O能与金属钠反应的有机物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb 为负极,发生还原反应 | |
| B. | 放电过程,正负极质量均增重 | |
| C. | 导线中每通过 1mole-,溶液中减少 2molH+ | |
| D. | 电子由 Pb 经外电路流向 PbO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 30 | 60 | 100 | 120 |
| 沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
| A.混合前,BaCl2溶液的物质的量浓度为0.10mol•L-1 |
| B.混合前,Na2SO4溶液的物质的量浓度为0.15mol•L-1 |
| C.3号实验中沉淀的质量x为1.398g |
| D.完全沉淀60mL Na2SO4溶液消耗BaCl2溶液的体积为80mL |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com