
| A. | 4.0gCuO和Cu2S的混合物含铜离子个数为0.05NA | |
| B. | 标准状况下,11.2LC5H12蒸气所含甲基数目最多为NA | |
| C. | 0.5molK与O2完全反应生成K2O,K2O2,KO3的混合物,转移电子数为0.5NA | |
| D. | 1L 0.2mol•L-1HI溶液中含I-数目为0.2NA |
分析 A.CuO和Cu2S中铜元素的质量分数相等,都是80%,混合物中铜元素的质量为6.4g,物质的量为0.1mol,铜原子个数为0.1NA;
B.气体摩尔体积使用对象为气体;
C.钾与氧气反应无论生成K2O,K2O2,KO3,钾都是从0价到+1价,依据价化合价变化计算转移电子数;
D.依据n=CV计算碘化氢的物质的量,碘化氢为强电解质完全电离,据此计算碘离子个数.
解答 解:A.8.0gCuO和Cu2S的混合物中含有铜元素的质量为:4.0g×$\frac{64}{80}$=3.2g,含有的铜的物质的量为0.05mol,含有铜原子数一定为0.05NA,故A正确;
B.标况下戊烷为液体,不能使用气体摩尔体积,故B错误;
C.K$\stackrel{e-}{→}$K+,1molK完全反应失去电子为NA,所以转移电子数为NA,则0.5molK与O2完全反应生成K2O,K2O2,KO3的混合物,转移电子数为0.5NA,则故C正确;
D.1L 0.2mol•L-1HI溶液,含有HI物质的量为1L×0.2mol/L=0.2mol,HI为强电解质,完全电离,所以0.2molHI电离生成0.2molI-,个数为0.2NA,故D正确;
故选:B.
点评 本题考查阿伏加德罗常数的应用及相关计算,注意物质的组成、结构、性质,掌握以物质的量为核心的计算公式是解题关键,注意气体摩尔体积使用条件和对象,题目难度中等.


科目:高中化学 来源: 题型:选择题
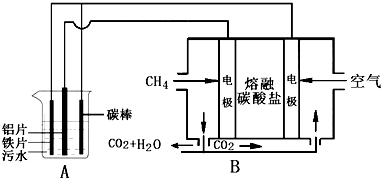
| A. | 装置B中通CH4一极电极反应为:CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 装置B中CO32-向CH4一极移动 | |
| C. | A中阳极相关反应有:Fe-2e-═Fe2+ 2H2O-4e-═4H++O2↑ 12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+ | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液与HNO3 | B. | Na2SO3固体与浓硫酸 | ||
| C. | 固体硫在纯氧中燃烧 | D. | 碳与热浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
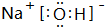 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 12mol•L-1盐酸溶液与足量MnO2共热,反应生成的气体分子数为0.3NA | |
| B. | 密闭反应容器中充入2mol SO2和1mol O2,充分反应转移电子数为4NA | |
| C. | 25.0g胆矾晶体溶于水配成1L溶液,所得溶液中阳离子数为0.1NA | |
| D. | 常温常压下,0.1mol C5H12所含有的共价键数目为1.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com