
【题目】某科研团队报道了以LiAlCl4离子液体作为电解质的铝离子二次电池,其放电工作原理如图所示。下列说法错误的是( )
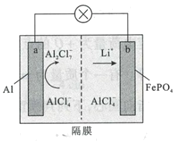
A.充电时,b极质量减小
B.放电时,阴离子向a极移动
C.充电时,正极反应为4Al2C1![]() +3e-=Al+7AlCl4
+3e-=Al+7AlCl4
D.放电时,阴极反应为FePO4+Li++e-=LiFePO4
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式________。
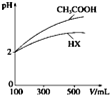
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)。
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中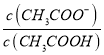 =____________。
=____________。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
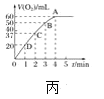
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
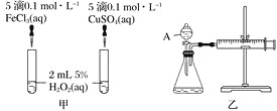
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

①343K时反应的平衡转化率α=___%。平衡常数K343K=__(保留2位小数)。
②在343K下:要提高SiHCl3转化率,可采取的措施是__;要缩短反应达到平衡的时间,可采取的措施有___、___。
③比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=![]() -
-![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___(保留1位小数)。
=___(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含FeTiO3及少量的CaO、Fe2O3、SiO2)为原料生产钛白粉的工艺流程如图:
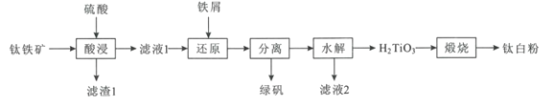
回答下列问题:
(1)“酸浸”是用硫酸在温度为150~200℃下溶煮钛铁矿,“滤液1”中的主要成分中含有TiOSO4,则“酸浸”中主要发生的反应方程式为___。
(2)“滤渣1”的主要成分有___。
(3)“还原"中加入过量铁屑的目的是___。
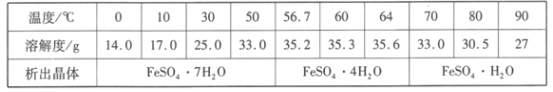
(4)硫酸亚铁晶体的溶解度如下表所示,其中绿矾(FeSO4·7H2O)容易被氧化,则“分离”得到绿矾的操作为___。
(5)“水解”需要加热至90℃的目的是___。
(6)“滤液2”可返回到___工序循环利用。
(7)工业上将钛白粉与焦炭、氯气共热生成TiCl4和一种可燃气体,反应的化学方程式为___,最后在氩气氛围和加热的条件下用金属镁还原TiCl4制取性能优越的金属钛。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为_______________________;
(2)用H2表示从0~2 min内该反应的平均速率v(H2)=_____________;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为______________。(用字母填空,下同);
a.v(NH3)=0.05 mol·L-1·min-1 b.v(H2)=0.03 mol·L-1·min-1
c.v(N2)=0.02 mol·L-1·min-1 d.v(H2)=0.00 l mol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是_____________。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成n mol N2的同时,生成3n mol H2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3mol H—H键断裂的同时2mol N—H键也断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
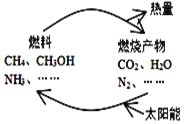
(1)在图构想的物质和能量循环中太阳能最终转化为______能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)①用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的______极(填“正”或“负”),通入氧气一极的电极反应式:_________。
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,其负极的电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验装置和操作,回答有关问题。

按图中所示装置,用两种不同的操作分别进行实验,观察B容器中的现象。
(1)先夹紧止水夹a,再使A容器中开始反应:①实验中B容器中观察到的现象是_________________;
②B容器中发生反应的离子方程式是____________________________________。
(2)打开止水夹a,使A容器开始反应一段时间后再夹紧止水夹a,①实验中观察到的现象是__________;②B容器中发生反应的离子方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com