
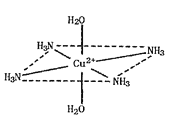
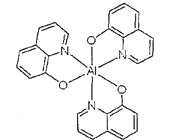
����Ŀ��������ͭ��Һ����εμ�Ũ��ˮ���ȳ�������a�������μ�Ũ��ˮ������a����ʧ���õ�һ�ֺ����������ӵ�����ɫ����Һ�����������Ҵ�����������ɫ�ľ���[Cu��NH3��4]SO4H2O�����ֶ��������ӵ�����ṹ��ͼ��ʾ��4��NH3��Cu2+���棬��H2O-Cu2+-H2O���ߴ�ֱ������ش��������⣺
��1����̬Cuԭ�ӵļ۵��ӹ����ʾʽ__��
��2������ͭˮ��Һ�μ�Ũ��ˮ�ı仯���̣�����a��__��д����������ɫ����Һ�����ӷ���ʽ�� __��
��3��NH3��Cu2+���γ�[Cu��NH3��4]2+�����ӡ���֪NF3��NH3������ͬ�Ŀռ乹�ͣ���NF3������Cu2+�γ������ӣ���ԭ����__��
��4�����ڶ��������ӵ�����ṹͼ������������ʾ�����е���λ��__��
��5����֪������CuO��Cu2O+O2����ͭԭ�Ӽ۲���ӽṹ�仯�Ƕ�������������Cu2O��ԭ����__��
���𰸡�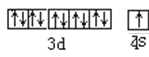 �γ���ɫ���� Cu��OH��2+4NH3H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O F�ĵ縺�Ա�N��N-F�ɼ����Ӷ�ƫ��F������NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ��
�γ���ɫ���� Cu��OH��2+4NH3H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O F�ĵ縺�Ա�N��N-F�ɼ����Ӷ�ƫ��F������NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ�� 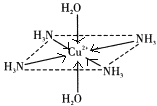 CuO��ͭ�ļ۲�����Ų�Ϊ3d9��Cu2O��ͭ�ļ۲�����Ų�Ϊ3d10�����ߴ����ȶ���ȫ����״̬��ǰ�߲���
CuO��ͭ�ļ۲�����Ų�Ϊ3d9��Cu2O��ͭ�ļ۲�����Ų�Ϊ3d10�����ߴ����ȶ���ȫ����״̬��ǰ�߲���
��������
(1)CuΪ29��Ԫ�أ��۵����Ų�Ϊ3d104s1��
(2)������ͭ��Һ�еΰ�ˮ����ˮ������ͭ��Ӧ��������������ͭ��ɫ����������ˮ����ʱ����ˮ��������ͭ��Ӧ���ɿ����Ե�ͭ������ע��������ӵ�����ṹ��֪����[Cu(NH3)4(H2O)2]2+���ӣ��ݴ���д����ʽ��
(3)NF3��N-F�ɼ����Ӷ�ƫ����Fԭ�ӣ�Nԭ���ϵŶԵ�������ͭ�����γ������ӣ�
(4)������У���λ���ṩ�µ��Ӷԣ�����ԭ���ṩ�չ���γ���λ����[Cu(NH3)4(H2O)2]2+�У�Cu2+�ṩ�չ����N��Oԭ���ṩ�¶Ե��ӣ��ݴ˱����ѧ����
(5)������CuO��Cu2O+O2��Cu2+�ļ۵���Ϊ3d9��Cu+�ļ۵���Ϊ3d10��������Cu+���ȶ���
(1)ͭ��29��Ԫ�أ��۵����Ų�Ϊ3d104s1������۵��ӹ����ʾʽΪ��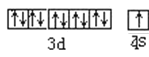 ��
��
(2)������ͭ��Һ�еΰ�ˮ����ˮ������ͭ��Ӧ��������������ͭ��ɫ������������a���γ���ɫ�����������μӰ�ˮ�������ܽ⣬��ˮ��������ͭ��Ӧ���ɿ����Ե�ͭ������ע��������ӵ�����ṹ��֪����[Cu(NH3)4(H2O)2]2+���ӣ���Ӧ�����ӷ���ʽΪ��Cu(OH)2+4NH3H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O��
(3)F�ĵ縺�Դ���NԪ�أ�NF3��N-F�ɼ����Ӷ�ƫ����Fԭ�ӣ�����NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ��Nԭ���ϵŶԵ�������ͭ�����γ������ӣ�����NF3������Cu2+�γ������ӣ�
(4)����ͭ�Ͱ�ˮ��Ӧ����������ͭ��ɫ�����������Ӱ�ˮʱ��������ͭ�Ͱ�ˮ������Ӧ��Cu2+�ṩ�չ����Nԭ���ṩ�¶Ե��ӣ�����������ʹ��Һ���壬[Cu(NH3)4(H2O)2]2+Ϊ�����ӣ�Cu2+�ṩ�չ����N��Oԭ���ṩ�¶Ե��ӣ�������λ����ϣ��˻�ѧ���ɱ�ʾΪ��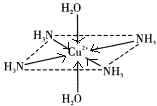 ��
��
(5)������CuO��Cu2O+O2��Cu2+�ļ۵���Ϊ3d9��Cu+�ļ۵���Ϊ3d10��������Cu+���ȶ�������ܹ�����Cu2O��ԭ����Խ���Ϊ��CuO��ͭ�ļ۲�����Ų�Ϊ3d9��Cu2O��ͭ�ļ۲�����Ų�Ϊ3d10�����ߴ����ȶ���ȫ����״̬��ǰ�߲��ǡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
���������������ճ�����������Ӧ�ù㷺�IJ��ϡ���ش��������⣺
��l����̬��ԭ�ӵļ۵��ӹ������ʽΪ__________��
��2����Ԫ�س�����������Fe2+��Fe3+���ȶ���Fe2+_______Fe2+����������������С����)��ԭ����________________��
��3�������������ܴ�����ƽ���NH4ClO4�ķֽ⣬NH4+�ĽṹʽΪ______�������λ�������ռ乹��Ϊ_________�����е�ԭ�ӵ��ӻ���ʽΪ_______����ClO4-��Ϊ�ȵ�����ķ��ӻ�������__________����д���֣���
��4������������ԭ�Ӳ���________�ѻ���������Ŀռ�������Ϊ______���ú�����ʽ�ӱ�ʾ����
��5��ij�����������������ᄃ����ͼ��ʾ������A��B������ɡ����Ȩ������Fe2+��Fe3+��O2-�ĸ�����Ϊ_______������������ȣ�����֪�þ�����ܶ�Ϊdg/cm3�������ӵ�������ֵΪNA����Ʒ������a Ϊ_______nm���ú�d ��NA�Ĵ���ʽ��ʾ����
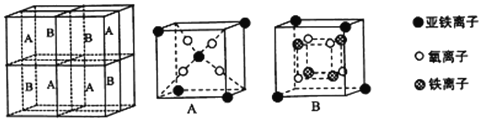
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.2-��ϩ������˳���칹��
B.��֪����Ķ��ȴ����������칹�壬�������ȴ�����칹����ĿΪ����
C.�ƵĽṹ��ʽΪ ���������ᷴӦ��������4��һ����ȡ����
���������ᷴӦ��������4��һ����ȡ����
D.��ȩ�ĺ˴Ź����������ж����壬�����֮����1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڼ��Է���NCl3�У�Nԭ�ӵ��ӻ�����Ϊ________���÷����е�Ԫ�ػ��ϼ�Ϊ��3��Clԭ�ӵĻ��ϼ�Ϊ+1�����Ʋ�NCl3ˮ�����Ҫ������________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɰ�Ǻ��ᾧˮ���������ƣ���������Xm-����B��O��H����Ԫ�أ������ģ����ͼ��ʾ������˵����ȷ���ǣ� ��
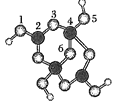
A.m=2
B.��Xm-�У���ԭ�ӹ�����ӻ�������ͬ
C.1��2ԭ�Ӽ��4��5ԭ�Ӽ�Ļ�ѧ����������λ��
D.��382g��ɰ�����к�2molNa+������ɰ�Ļ�ѧʽΪNa2B4O710H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ��12�����������з�������ʯīϩ���ӵ�ⷢ����ϣ����ɹ�Ӧ�õ���WLED�����У�2019��8�£��й���ѧԺ�������ʽṹ�о����ϳ�������ȱ���յ��ľ�̬�������ε�һ��ְ����Ba2[Sn��OH��6][B��OH��4]2��������˸û������LED������
��1��ʯīϩ��ͼ����һ���ɵ���̼ԭ�ӹ��ɵ�ƽ��ṹ����̼���ϣ�ʯīϩ�в���̼ԭ�ӱ���������ƽ��ṹ�ᷢ���ı䣬ת��Ϊ����ʯīϩ��ͼ��
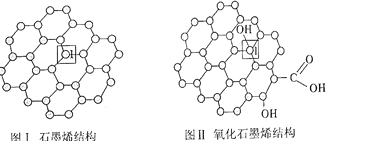
����ʯīϩ�����У�ÿ��Cԭ������__����Ԫ����ÿ����Ԫ��ռ��___��Cԭ�ӡ�
��ͼ����1��C������C�γɵļ���__����������������������=����ͼ����1��C������C�γɵļ��ǣ�������__��
��2����֪���������黯������ͬ�־������͡��黯���Ե������뵼�����ƣ��۵�Ϊ1230�棬���пռ���״�ṹ�����־����۵�ϸߵ���__���ѧʽ������������__��
��3��8-�ǻ��������OLED�е���Ҫ������ϼ����Ӵ�����ϣ����۽ṹ��ͼ��ʾ��8-�ǻ�������д��ڵĻ�ѧ��Ϊ___��
A�����Ӽ� B�����Լ� C���Ǽ��Լ� D����λ�� E������ F��������
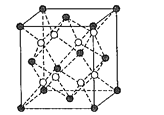
��4����֪BaF2���������������ṹ�������ṹ��ͼ��ʾ�������д���Fԭ�ӵ���__������������������������֪BaF2��������Ϊapm���谢���ӵ�������ֵΪNA����BaF2���ܶ���__gcm-3���г��������ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⣨MoO3����ʯ��ҵ�г��õĴ�����Ҳ���´���ҩ�����ϣ������ʳ�ʹ�û������Ҫ�ɷ�
ΪMoS2��ͨ��һ���������Ʊ����ش�����������⣺
(1)��֪����MoS2(s)Mo(s)+S2(g) ��H1��
��S2(g)+2O2(g)2SO2(g) ��H2��
��2Mo(s)+3O2(g)2MoO3(s) ��H3
��2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) ��H=______���ú���H1����H2����H3�Ĵ���ʽ��ʾ����
(2)���ں��º��������½�������ӦMoS2(s)Mo(s)+S2(g)
������˵����ȷ����______������ĸ����
a��������ܶȲ��䣬��Ӧһ���ﵽ�� ƽ��״̬
b���������Է����������䣬��Ӧ�������� ƽ��״̬
c������MoS2������ƽ�������ƶ�
�ڴﵽƽ��ʱS2(g)��Ũ��Ϊ1.4 molL-1������һ������S2(g)����Ӧ�ٴδﵽƽ�⣬S2��g��Ũ��______������������������=����1.4 molL-1��
(3)��2L�����ܱ������г���1.0 molS2(g)��1.5 mol O2(g)������������Ӧ��S2(g)+2O2(g)2SO2(g)��5 min��Ӧ�ﵽƽ�⣬��ʱ����ѹǿΪ��ʼʱ��80%����0��5 min�ڣ�S2(g)�ķ�Ӧ����Ϊ______molL-1min-1��
(4)�ں����ܱ������У�����������MoS2��O2����������Ӧ��2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) ��H�����������ƽ��ת��������ʼѹǿ���¶ȵĹ�ϵ��ͼ��ʾ��
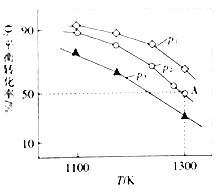
�١�H______����������*��������=����0���Ƚ�p1��p2��p3�Ĵ�С��______
������ʼʱͨ��7.0molO2��p2Ϊ7.0 kPa����A��ƽ�ⳣ��Kp=______��������ƽ���ѹ��������ƽ��Ũ�ȼ��㡣��ѹ=��ѹ����������ʵ���������д������ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(��Ҫ��Ⱦ��SO2��NOX)��O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ��������е�SO2��NOx �ĺ�����
(1) O3����������SO2��NOx ����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ�� NO(g)��O3(g)![]() NO2(g)+ O2(g) ��H����200.9 kJ��mol-13NO(g)��O3(g)
NO2(g)+ O2(g) ��H����200.9 kJ��mol-13NO(g)��O3(g)![]() 3NO2(g) ��H����317.3kJ��mol-1����2NO2(g)
3NO2(g) ��H����317.3kJ��mol-1����2NO2(g)![]() 2NO(g)+O2(g)����H��_____________kJ��mol-1
2NO(g)+O2(g)����H��_____________kJ��mol-1
(2)T��ʱ�����ò�ѹ���ڸ��Է�Ӧ���У�Ͷ��һ������NO2������Ӧ3NO2(g)![]() 3NO(g)��O3(g)����ϵ����ѹǿ p��ʱ�� t�ı仯���±���ʾ��
3NO(g)��O3(g)����ϵ����ѹǿ p��ʱ�� t�ı仯���±���ʾ��
��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
�������ͷ�Ӧ�¶ȣ���ƽ�����ϵѹǿ p______24.00 MPa(����>������<����������),ԭ����____________��
��15min ʱ����Ӧ���ת���� ��=______��
��T��ʱ��Ӧ3NO2(g)![]() 3NO(g)��O3(g)��ƽ�ⳣ��Kp=____________(Kp Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ������ѹ���Ը���������ʵ�������)
3NO(g)��O3(g)��ƽ�ⳣ��Kp=____________(Kp Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ������ѹ���Ը���������ʵ�������)
(3)T��ʱ�������Ϊ2L���ܱո��������У�Ͷ��2 mol NO2������Ӧ2NO2(g)![]() 2NO(g)��O2(g)��ʵ���ã�v��=k�� c2(NO2)��v��=k�� c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣���¶�ΪT��ʱNO2��ת������ʱ��仯�Ľ����ͼ��ʾ(��Ӧ��5.5minʱ�ﵽƽ��)��
2NO(g)��O2(g)��ʵ���ã�v��=k�� c2(NO2)��v��=k�� c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣���¶�ΪT��ʱNO2��ת������ʱ��仯�Ľ����ͼ��ʾ(��Ӧ��5.5minʱ�ﵽƽ��)��

�����������ĸ��������У�Ͷ��̶�����NO2������Ӧ��Ҫ���NO2ת���ʣ��ɲ�ȡ�Ĵ�ʩ��______________��___________��
����ͼ�����ݣ�����÷�Ӧ��ƽ�ⳣ��Ϊ_________��
�ۼ���A �㴦v��/v��=_________________________(����1λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ̽��ͭ��ϡ���ᷴӦ����̬�������Ƿ�NO2����������ʵ�顣
��֪�� FeSO4+NO��[Fe(NO)]SO4���÷�Ӧ�ϻ�����������һ����[Fe(NO)]2+ʱͻ��������ɫ��

��1��ʵ��ǰ�����װ�õ������ԣ���������_____________________________________��
��2��ʵ�鿪ʼʱ�Ƚ�Y���Թ���ʢ��̼��Ƶ�֧����б����������ϡ���ᣬ��ʵ�������Ŀ����__________________________________________________________________��ͭƬ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ________________________________��
��3��ϴ��ƿ�м���KSCN��Һ��Ŀ�ļ�ԭ����______________________________________����ʵ��ֻ�۲쵽ϴ��ƿ�г�������ɫ��д��β�������Ļ�ѧ����ʽ________________��
��ʵ�����Ʊ���CuSO4��5H2O�г���Cu(NO3)2�����������ⶨCuSO4��5H2O�ĺ�����
��4��ʵ�鲽��Ϊ����___________�ڼ�ˮ�ܽ�ۼ��Ȼ�����Һ�������ܹ��ˣ����ಽ��ʡ�ԣ����ڹ���ǰ����Ҫ�����Ƿ������ȫ���������_________________________________��
��5����1.040 g�����к�CuSO4��5H2O��ȷֵΪ1.015 g����ʵ��ⶨ�����l.000 g �ⶨ��������Ϊ____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com