
【题目】煤、石油是人类目前使用的主要能源,同时也是重要的化工原料。
Ⅰ.石油经分馏、裂化、裂解可以获得C4H10、CH4、C3H6、C2H6、C2H4等许多重要的化工原料。
已知:i.C4H10(g)![]() CH4(g)+C3H6(g)
CH4(g)+C3H6(g)
ii.C4H10(g)![]() C2H6(g)+C2H4(g)
C2H6(g)+C2H4(g)
CH3CH2CH2CH3与![]() 的平衡转化率随温度变化的关系如图1所示。
的平衡转化率随温度变化的关系如图1所示。

(1)![]() 的名称是___;其一氯代物有___种,结构简式分别是___。
的名称是___;其一氯代物有___种,结构简式分别是___。
(2)660℃时,取1molCH3CH2CH2CH3通入2L恒容密闭容器中发生反应i、ii,经过30min达到平衡,C2H6的体积分数为![]() 。
。
①达平衡时反应物转化率为___,30min内,用C2H6表示的平均反应速率v(C2H6)为___。
②达到平衡时,CH4的物质的量分数为___%(精确到0.1)。
Ⅱ.用煤干馏得到的二甲苯和乙烯为原料合成涤纶(聚酯纤维)的路线如下:

(3)①写出A![]() B的化学方程式:__,反应类型是___。
B的化学方程式:__,反应类型是___。
②若1mol![]() 与1mol
与1mol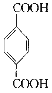 酯化反应的生成物中含两个环,写出该物质的结构简式:___;若生成物中只含一个环,写出反应的化学方程式___。
酯化反应的生成物中含两个环,写出该物质的结构简式:___;若生成物中只含一个环,写出反应的化学方程式___。
【答案】2-甲基丙烷 2 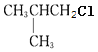 、
、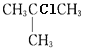 70% 0.005mol/(L·min) 23.5 CH2=CH2+Br2
70% 0.005mol/(L·min) 23.5 CH2=CH2+Br2![]() CH2BrCH2Br 加成反应
CH2BrCH2Br 加成反应 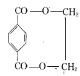
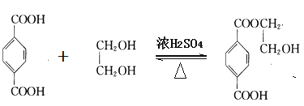 +H2O
+H2O
【解析】
(1)![]() 主链有3个C,支链在2号位上,名称是2-甲基丙烷;结构中三个甲基的环境相同,一共有两种不同环境的氢,它的一氯代物只有2种;
主链有3个C,支链在2号位上,名称是2-甲基丙烷;结构中三个甲基的环境相同,一共有两种不同环境的氢,它的一氯代物只有2种;
(2)①由图可知,660℃时CH3CH2CH2CH3的平衡转化率为70%;由反应方程式可知,每反应1分子CH3CH2CH2CH3时,生成两分子的气体,即体积增大两倍,平衡时反应的CH3CH2CH2CH3的物质的量为1mol×70%=0.7mol,剩余CH3CH2CH2CH30.3mol,则此时总物质的量为0.7mol×2+0.3mol=1.7mol,生成C2H6的物质的量为1.7mol×![]() =0.3mol,可以求出反应速率;
=0.3mol,可以求出反应速率;
②由①可知,达到平衡时,C2H6的物质的量为0.3mol,则生成C2H4的物质的量也是0.3mol,可知CH4的物质的量=(0.7mol×2-0.3×2)×0.5=0.4mol;
(3)①A![]() B是乙烯和溴单质的加成反应,方程式为:CH2=CH2+Br2
B是乙烯和溴单质的加成反应,方程式为:CH2=CH2+Br2![]() CH2BrCH2Br;反应类型是加成反应;
CH2BrCH2Br;反应类型是加成反应;
②1mol![]() 与1mol
与1mol 酯化反应中两个羟基分别和两个羧基结合,生成两个环的有机物是
酯化反应中两个羟基分别和两个羧基结合,生成两个环的有机物是 ;若生成物中只含一个环则
;若生成物中只含一个环则![]() 中的一个羟基和
中的一个羟基和 一个羧基发生酯化反应,方程式为
一个羧基发生酯化反应,方程式为 +H2O。
+H2O。
(1)![]() 主链有3个C,支链在2号位上,名称是2-甲基丙烷;结构中三个甲基的环境相同,一共有两种不同环境的氢,它的一氯代物只有2种,结构简式分别是
主链有3个C,支链在2号位上,名称是2-甲基丙烷;结构中三个甲基的环境相同,一共有两种不同环境的氢,它的一氯代物只有2种,结构简式分别是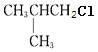 、
、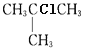 ;
;
(2)①由图可知,660℃时CH3CH2CH2CH3的平衡转化率为70%;由反应方程式可知,每反应1分子CH3CH2CH2CH3时,生成两分子的气体,即体积增大两倍,平衡时反应的CH3CH2CH2CH3的物质的量为1mol×70%=0.7mol,剩余CH3CH2CH2CH30.3mol,则此时总物质的量为0.7mol×2+0.3mol=1.7mol,生成C2H6的物质的量为1.7mol×![]() =0.3mol,则C2H6表示的平均反应速率v(C2H6)=
=0.3mol,则C2H6表示的平均反应速率v(C2H6)=  =0.005mol/(L·min);
=0.005mol/(L·min);
②由①可知,达到平衡时,C2H6的物质的量为0.3mol,则生成C2H4的物质的量也是0.3mol,可知CH4的物质的量=(0.7mol×2-0.3×2)×0.5=0.4mol,CH4的物质的量分数为![]() ×100%=23.5%;
×100%=23.5%;
(3)①A![]() B是乙烯和溴单质的加成反应,方程式为:CH2=CH2+Br2
B是乙烯和溴单质的加成反应,方程式为:CH2=CH2+Br2![]() CH2BrCH2Br;反应类型是加成反应;
CH2BrCH2Br;反应类型是加成反应;
②1mol![]() 与1mol
与1mol 酯化反应中两个羟基分别和两个羧基结合,生成两个环的有机物是
酯化反应中两个羟基分别和两个羧基结合,生成两个环的有机物是 ;若生成物中只含一个环则
;若生成物中只含一个环则![]() 中的一个羟基和
中的一个羟基和 一个羧基发生酯化反应,方程式为
一个羧基发生酯化反应,方程式为 +H2O。
+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是
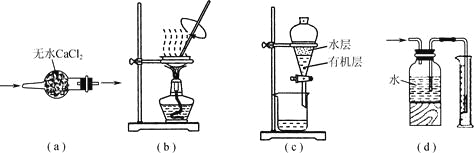
A.用图a所示装置干燥SO2气体
B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体
C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D.用图d所示装置测量氯气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是![]()
选项 | 实验 | 现象 | 结论 |
A | 向2mL | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B | 往 | 产生白色胶状沉淀 | 酸性: |
C | 常温下将铝片加入浓硝酸中 | 无明显现象 | 铝与浓硝酸不反应 |
D | 将 | 紫色溶液褪色 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼![]() 又称联氨,是一种可燃性的液体,可用作火箭燃料,其燃烧产物为无害物质。已知在
又称联氨,是一种可燃性的液体,可用作火箭燃料,其燃烧产物为无害物质。已知在![]() ,101kPa时,
,101kPa时,![]() 的燃烧热为
的燃烧热为![]() ,其分子的球棍模型如图所示。下列说法正确的是( )
,其分子的球棍模型如图所示。下列说法正确的是( )

A.标准状况下,![]() 含有共价键的总数为
含有共价键的总数为![]()
B.![]() 和
和![]() 含有的电子总数不相等
含有的电子总数不相等
C.在![]() ,101kPa时,若
,101kPa时,若![]() 充分燃烧放出624kJ热量,则转移电子的数目为
充分燃烧放出624kJ热量,则转移电子的数目为![]()
D.![]() 和
和![]() 含有的化学键类型完全相同
含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类生活中最常见、应用最广泛的金属,钢铁在空气中很容易被腐蚀。
(1)炒过菜的铁锅未及时洗净(残液中含有 NaCl),不久便会因腐蚀而出现褐色锈斑。铁锅锈蚀的电极反应式为:负极___________________________,正极___________________________。
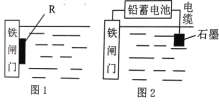
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图 1 所示的方案,其中焊接在铁闸门上的固体材料 R 可以采用 _______________ (填序号)。
A、铜 B、锌 C、钠 D、石墨
(3)图 2 所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在铅蓄电池的_______极上(填“正”或“负”)。
(4)常温下以铅蓄电池为电源,用石墨作电极电解 1L 0.1mol/L NaCl溶液,电解一段时间后,测得溶液的 pH 为 13,则铅蓄电池中转移电子的物质的量为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述正确的是
A.已知![]()
![]()
![]() ,则氢气的燃烧热为
,则氢气的燃烧热为![]()
B.![]() ,石墨
,石墨![]() ,金刚石
,金刚石![]() ,说明石墨比金刚石稳定
,说明石墨比金刚石稳定
C.![]() ,
,![]() 恒温恒容条件下达到平衡后加入X,上述反应的
恒温恒容条件下达到平衡后加入X,上述反应的![]() 增大
增大
D.已知![]() ;
;![]() 则
则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2 。下列关于该电池的说法错误的是( )

A. 食盐水作为电解质溶液
B. 电池工作时镁片作为正极逐渐被消耗
C. 电池工作时实现了化学能向电能的转化
D. 活性炭电极上的反应为O2+2H2O + 4e- = 4OH -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
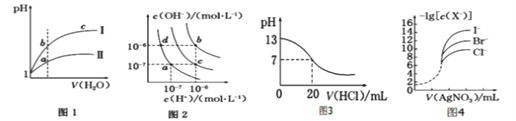
A. 图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强
B. 图2 中纯水仅升高温度,不能使a点变到c点
C. 图3 表示25 ℃时,用0.100 0 molL-1HCl 滴定20 mL 0.100 0 molL-1NaOH 溶液,溶液的pH随加入盐酸体积的变化
D. 用0.010 0 molL-1AgNO3标准溶液滴定浓度均为0.100 0 molL-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com