
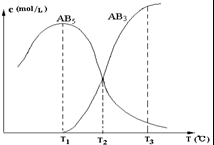
 在一密闭的容器中,由一定量的A4(s)和B2(g)反应,可得到AB5(g)和AB3(g)二种产物,生成物在各个温度下的平衡浓度c与温度T的关系如图.下列说法错误的是( )
在一密闭的容器中,由一定量的A4(s)和B2(g)反应,可得到AB5(g)和AB3(g)二种产物,生成物在各个温度下的平衡浓度c与温度T的关系如图.下列说法错误的是( )| A、AB5(g)?AB3(g)+B2(g)其反应的反应热△H>0 | B、A4(s)+10B2(g)?4AB5(g)其反应的反应热△H<0 | C、在T2时刻,保持温度不变,给体系加压,达到新平衡时,n(AB5)>n(AB3) | D、在T1、T2、T3时,容器中B2的物质的量的大小关系为n(B2,T3)>n(B2,T2)>n(B2,T1) |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
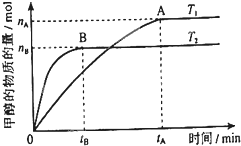 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:| nA |
| tA |
| 2-a |
| 2 |
| 2-a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
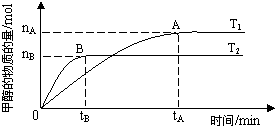 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 2-a |
| 2 |
| 2-a |
| 2 |
查看答案和解析>>
科目:高中化学 来源:潮州市2008年高考第二次模拟测试、化学试题 题型:021
|
在一密闭的容器中,由一定量的A4(s)和B2(g)反应,可得到AB5(g)和AB3(g)二种产物,生成物在各个温度下的平衡浓度c与温度T的关系如图.下列说法错误的是
| |
A. |
AB5(g) |
B. |
A4(s)+10B2(g) |
C. |
在T2时刻,保持温度不变,给体系加压,达到新平衡时,n(AB5)>n(AB3) |
D. |
在T1、T2、T3时,容器中B2的物质的量的大小关系为n(B2,T3)>n(B2,T2)>n(B2,T1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭的容器中,由一定量的A4(s)和B2(g)反应,可得到AB5(g)和AB3(g)二种产物,生成物在各个温度下的平衡浓度c与温度T的关系如图。下列说法错误的是( )
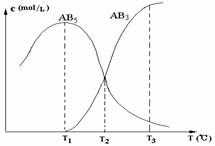
A.AB5(g)![]() AB3(g)+B2(g)其反应的反应热ΔH>0
AB3(g)+B2(g)其反应的反应热ΔH>0
B.A4(s)+10B2(g) ![]() 4AB5(g) 其反应的反应热ΔH<0
4AB5(g) 其反应的反应热ΔH<0
C.在T2时刻,保持温度不变,给体系加压,达到新平衡时,n(AB5)>n(AB3)
D.在T1、T2、T3时,容器中B2的物质的量的大小关系为n(B2,T3)>n(B2,T2)>n(B2,T1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com