
以下除杂方法(括号内为少量杂质)中,错误的是( )
A.NaCl(Na2CO3):溶解,滴入足量盐酸,蒸发结晶
B.Na2SO4(NH4Cl):加热、升华
C.CO2(CO):通过灼热CuO粉末
D.H2(NH3):通过盛浓H2SO4的洗气瓶
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下产生的CO2体积相等
B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y为同周期元素,且第一电离能X<Y,下列说法中正确的是( )
A.电负性:X<Y B.周期表中,X可能在Y的右边
C.若X与Y形成化合物,则X显正价,Y显负价 D.气态氢化物的稳定性:HmY强于HnX
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
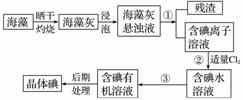
(1)实验室焙烧海带,需要下列仪器中的________(填字母)。
a.试管 b.烧杯
c.坩埚 d.泥三角
e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③__________。
(3)提取碘的过程中,可选择的有机试剂是________。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______、______________。
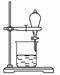
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈______色;他们打开分液漏斗活塞,却未见液体流下,原因可能是
________________________________________________________________________。
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
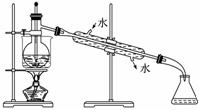
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(7)进行上述蒸馏操作时,使用水浴加热的原因是_______________________________,
最后晶态碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
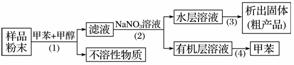
下列说法错误的是( )
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方法正确的是( )
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯
A.①②③ B.②④⑤ C.③④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
试根据下表回答问题。
某些共价键的键长数据如下所示:
| 共价键 | 键长(nm) |
| C—C | 0.154 |
| C===C | 0.134 |
| C≡C | 0.120 |
| C—O | 0.143 |
| C===O | 0.122 |
| N—N | 0.146 |
| N===N | 0.120 |
| N≡N | 0.110 |
根据表中有关数据,你能推断出影响共价键键长的因素主要有哪些?其影响的结果怎样?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D.非极性分子中,一定含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚。甲醚是乙醇的同分异构体,其熔点为-141.5 ℃,沸点为-24.9 ℃,在加热条件下可分解成甲烷、乙烷、甲醛等。
(1)乙醇的沸点比甲醚高,其主要原因是________________________________________________________________________。
(2)甲醛分子中碳原子轨道的杂化类型为________________________________________________________________________。
(3)储氢材料化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会缓慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为______________(若含有配位键,要求用箭头表示),1 mol化合物B中σ键的数目是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com