
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3 mol电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)________L。
(2)反应②中________作氧化剂,________是氧化产物。
(3)当反应②中生成11.2 L SO2气体(标准状况下)时,被还原的H2SO4的物质的量是________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)__________。
(5)反应③中氧化产物与还原产物的物质的量之比为__________。
【答案】147 33.6 H2SO4(浓); CuSO4 0.5 mol 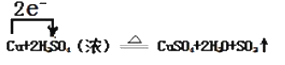 5:1
5:1
【解析】
(1)反应①中1mol Fe参与反应,消耗稀硫酸1mol,电子转移2mol。
(2)由反应方程式可知,反应中Cu从0价升高到+2价,失去电子,发生氧化反应,S从+6价降低到+4价,得到电子,发生还原反应;
(3)反应②中,生成1mol SO2气体,被还原的H2SO4的物质的量为1mol;
(4)反应②中S从+6价降低到+4价,得到电子,发生还原反应, Cu从0价升高到+2价,失去电子,发生氧化反应;
(5)反应③中Cl从+5价降低到0价,从-1价升高到0价,Cl2既是氧化产物又是还原产物;
(1)当反应①转移3 mol电子时,消耗H2SO4的的物质的量为1.5mol,质量为1.5mol×98g/mol=147g;产生氢气的物质的量为1.5mol,标况下的体积为1.5mol×22.4L/mol=33.6L;
(2)反应②中S从+6价降低到+4价,得到电子,发生还原反应,硫酸为氧化剂,Cu从0价升高到+2价,失去电子,发生氧化反应,Cu为还原剂,得到的产物CuSO4为氧化产物;
(3)当反应②中生成11.2 L (即0.5mol)SO2气体时,被还原的H2SO4的物质的量是0.5mol;
(4)反应②中S从+6价降低到+4价,得到电子,发生还原反应, Cu从0价升高到+2价,失去电子,发生氧化反应,因此电子转移的方向和数目为: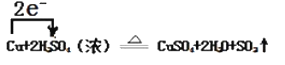 ;
;
(5)反应③中Cl2既是氧化产物又是还原产物,物质的量之比为5:1。


科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )

A. 形成锌-铜原电池 B. 实验室制备乙酸乙酯
C. 证明酸性:CHCOOH>H2CO3>硅酸 D. 石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解100mLHNO3 与AgNO3 的混合液,通电一段时间后,两极均收集到4.48L气体(标准状况),则原混合液中Ag+的物质的量浓度为( )
A. 1mol·L-1B. 2mol·L-1C. 2.5mol·L-1D. 4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
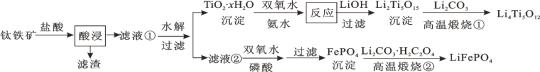
下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFeO4+H2O↑+3CO2↑
2LiFeO4+H2O↑+3CO2↑
D.TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
可知,40℃前,未达到平衡状态,随着温度升高,转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、Ca(OH)2溶液、BaCl2溶液、Ba(NO3)2溶液
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为________(只填化学式)。
(2)操作Ⅲ的名称是________,所需用到的仪器主要有铁架台、酒精灯、铁圈、玻璃棒__________(填仪器名称)。
(3)加盐酸的目的是(用离子方程式表示)_________________________
Ⅱ.一份无色溶液中可能含有Na+、Fe3+、H+、Mg2+、CO32-、OH-、HCO3-、Cl-、SO42-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①向溶液中滴加酚酞试液,溶液显红色:
②取2mL溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(4)原溶液中一定存在的离子是______________,一定不能大量存在的离子是_______________。
(5)经过上述操作后,还不能肯定是否存在的离子是________。对可能含有的离子,如何进行实验以进一步检验____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某无土栽培用的营养液,营养液要求KCl、K2SO4和NH4Cl 3种固体原料的物质的量之比为1:4:8。
(1) 配制该营养液后c(NH4+)=0.016 mol﹒L-1,溶液c(K+)=_______________。
(2) 若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为________
Ⅱ从1L 1 mol﹒L-1氢氧化钠溶液中取出100 mL:
(1)取出的这100 mL氢氧化钠溶液的物质的量浓度是______。若将取出的这100 mL氢氧化钠溶液加水稀释至500 mL,所得溶液的物质的量浓度是_____。
某学生计划用12 mol﹒L-1的浓盐酸配制0.1 mol﹒L-1的稀盐酸450 mL,回答下列问题:
(2)实验过程中,不必使用的是________(填字母)。
A.托盘天平 B.量筒 C.容量瓶 D.250 mL烧杯E.胶头滴管F.500 mL试剂瓶
(3)除上述仪器可使用外,还缺少的仪器是________。
(4)量取浓盐酸的体积为___ mL,应选用的量筒规格为______(提供10.0 mL、25.0 mL)。
(5)配制时应选用的容量瓶规格为______________。
(6)某同学操作出现以下情况,对所配溶液浓度将有何影响(填“偏高”“偏低”或“无影响”)。
定容时俯视刻度线__________加蒸馏水时不慎超过了刻度__________,此时应如何处理 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或解释正确的是( )
A.碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
B.少量二氧化硫通入氢氧化钠溶液中的化学方程式:SO2+NaOH=NaHSO3
C.碳酸氢钠溶液显碱性:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.向小苏打溶液中加入过量的石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求计算。
(1)0.5mol NaAlO2含有___mol Na+;_____mol AlO2-;含___个O。
(2)在100 mL 0.2 mol/L NaOH溶液中含溶质的物质的量___mol;配制50 mL 0.2 mol/LFeSO4溶液,需要FeSO4____ g。
(3)1.06 g的Na2CO3的物质的量是___mol;含有的CO32-离子数是___个。
(4)标准状况下,0.3 mol CH4的体积是___;含有碳原子质量是___;含有氢原子物质的量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为___。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是___反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是____(填序号)。
A.容器中N2、H2、NH3共存 B.N2、NH3浓度相等
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为____。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为___。
(4)如图是某笔记本电脑使用的甲醇空气燃料电池的结构示意图。放电时甲醇应从__处通入(填“a”或“b”),电池内部H+向__(填“左”或“右”)移动,写出负极的电极反应式__。
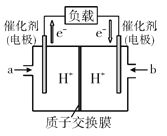
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com