
| A. | Na+的结构示意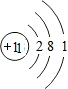 | |
| B. | CO2的结构式:O-C-O | |
| C. | CH4分子的比例模型为: | |
| D. | 用电子式表示氯化氢分子的形成过程:H•+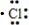 →H+[ →H+[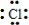 ]- ]- |
分析 A.钠离子核外电子数为10;
B.CO2分子中C原子与O原子之间形成2对共用电子对;
C.比例模型表明原子相对大小及空间结构、原子连接顺序,不能表现化学键成键情况;
D.HCl属于共价化合物.
解答 解:A.钠离子核外电子数为10,离子结构示意图为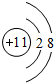 ,故A错误;
,故A错误;
B.CO2分子中C原子与O原子之间形成2对共用电子对,结构式为O=C=O,故B错误;
C.比例模型表明原子相对大小及空间结构、原子连接顺序,不能表现化学键成键情况,选项中模型为甲烷的比例模型,故C正确;
D.HCl属于共价化合物,用电子式表示氯化氢分子的形成过程为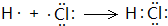 ,故D错误,
,故D错误,
故选:C.
点评 本题考查常用化学用语,涉及结构示意图、结构式、比例模型、电子式等,注意区别比例模型与球棍模型,理解掌握用电子式表示化学键或物质的形成过程.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向稀盐酸溶液中加铁:3Fe+6H+═3Fe3++3H2↑ | |
| D. | 向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.53g | B. | 5.30g | C. | 10.6g | D. | 11.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别碳酸钠和碳酸氢钠溶液,用澄清石灰水 | |
| B. | 除去碳酸氢钠溶液中的碳酸钠,用稀盐酸 | |
| C. | 除去MgCl2溶液中的FeCl3,加NaOH调pH | |
| D. | 检验FeCl2溶液中混有的FeCl3,可用NH4SCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +2 | C. | +3 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定不含Ba2+、Mg2+、SiO32-、Fe2+、SO32- | |
| B. | 该溶液中一定含有AlO2-、Cl-、K+ | |
| C. | 根据①推测可能发生下列反应:HCO3-+AlO2-+H2O═CO32-+Al(OH)3↓ | |
| D. | 原溶液中n(K+)>0.002mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入酚酞呈红色的溶液中:CO32-、NH4+、NO3-、K+ | |
| B. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| C. | 强酸性溶液中:Fe3+、NH4+、Cl-、SCN- | |
| D. | 含有NaHSO4的溶液中:NH4+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 氨水应密闭保存于低温处 | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)═2NH3(g)△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com