
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时,生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.②③④B.①③⑤C.①④⑥D.②⑥
【答案】C
【解析】
①单位时间内生成n mol O2,同时生成2n molNO2,说明反应v正=v逆,说明达到平衡状态,故①正确;
②无论反应是否达到平衡状态,单位时间内生成nmolO2的同时,一定生成2nmolNO,不能说明达到平衡状态,故②错误;
③如何时候,NO2、NO、O2物质的量浓度变化表示的反应速率之比均为2∶2∶1,不能说明达到平衡状态,故③错误;
④混合气体的颜色不再改变,说明NO2气体的浓度不变,说明达到平衡状态,故④正确;
⑤无论反应是否达到平衡状态,混合气体的质量不变,容器的体积不变,混合气体的密度始终不变,不能说明达到平衡状态,故⑤错误;
⑥反应前后气体的化学计量数之和不相等,当混合气体的平均相对分子质量不再改变的状态,说明混合气体的物质的量不变,说明达到平衡状态,故⑥正确;
达到平衡状态的有①④⑥,故选C。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. H2、I2、HI混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 工业上生产硫酸的过程中使用过量的空气,以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、![]() )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式: _________,指出使用空气比使用氯气好的原因是__________。
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=____________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________(填化学式,下同),用________试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-1
②C(s)+![]() O2(g)=CO(g)ΔH2=-110.45kJ·mol-1
O2(g)=CO(g)ΔH2=-110.45kJ·mol-1
下列说法正确的是
A.C的燃烧热是-110.45kJ·mol-1
B.若反应①中使用催化剂加快反应速率,单位时间内吸收更多热量,则ΔH1变大
C.反应①中的能量变化如图所示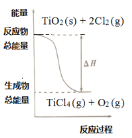
D.反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)ΔH=-45.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)![]() PCl5(g),并于10min时达到平衡。有关数据如下:
PCl5(g),并于10min时达到平衡。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是
A.10min内,v(Cl2)=0.04mol·L-1·min-1
B.当容器中Cl2为1.2mol时,反应达到平衡
C.升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的![]() <1
<1
D.平衡后移走2.0molPCl3和1.0molCl2,相同条件下再次平衡,c(PCl5)<0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O
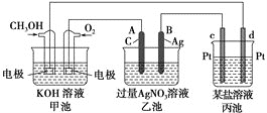
请回答:
(1)甲池是________池,通入O2的电极作为________极,电极反应式为__________。
(2)乙池是________池,A电极名称为________极,电极反应式为_______________。乙池中的总反应离子方程式为_____________________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为Na2SO4+2C![]() Na2S+2CO2↑。其主要流程如下:
Na2S+2CO2↑。其主要流程如下:
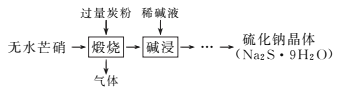
(1) Na2S溶液显碱性,写出相关反应的方程式(主要)______,上述流程中采用稀碱液比用热水更好,理由是___________。
(2)常温下,等体积、等物质的量浓度的NaHS溶液与Na2S溶液混合,混合溶液中c(S2-)_____c(HS-) (填“大于”、“小于”或“等于”)。若混合溶液的pH=10,则c(HS-)+3c(H2S)-c(S2-)= ___________________
(3)已知:I2+2S2O32-=2I-+S4O62-。上述所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1I2溶液滴定至终点,用去5.00mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是
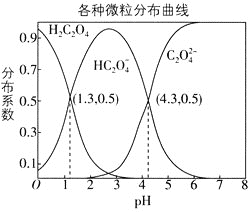
A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用制度,一律不得免费提供塑料购物袋。在全国范围内禁止生产、销售、使用厚度小于0.025毫米的塑料购物袋(简称超薄塑料购物袋)。下列说法不正确的是( )
A.在所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用制度,主要目的是控制塑料制品的使用,减少“白色污染”
B.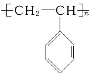 的单体是苯乙烯
的单体是苯乙烯
C.聚氯乙烯塑料强度大,抗腐蚀性强,可以用来包装需长时间保存的食品
D.用于食品包装的塑料制品,属于热塑性塑料,可回收再利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com