
【题目】通过以下反应均可获取H2。下列有关说法正确的是
①焦炭与水反应制氢:C(s)+ H2O(g) = CO(g)+ H2(g) ΔH1 = 131.3 kJ·mol–1
②太阳光催化分解水制氢:2H2O(l) = 2H2(g)+ O2(g) ΔH2 = 571.6 kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH3 = 206.1 kJ·mol–1
A. 反应①为放热反应
B. 反应②中电能转化为化学能
C. 若反应③使用催化剂,ΔH3不变
D. 反应2H2(g) + O2(g) = 2H2O(g)的ΔH = -571.6 kJ·mol–1
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出22.4 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的△H=-99 kJ·mol-1。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的△H=-99 kJ·mol-1。

(1)图中△H=___________kJ·mol-1(填数值);
(2)写出SO3(g)分解成SO2(g)和O2(g)的热化学方程式:_____________________。
(3)加入催化剂(V2O5)会使图中B点___________(填“升高”或“降低”)。
(4)从化学键角度分析,E表示的意义:______________________________。
(5)某工业生产实验数据如下:
温度 | 压强不同时SO2的转化率(%) | ||||
1.01×105 Pa | 5.05×105 Pa | 1.01×106 Pa | 5.05×106 Pa | 1.01×107 Pa | |
450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
你认为最适宜的条件是______________________。
(6)已知由S(s)生成3 mol SO3(g)共放出1185 kJ的热量,单质硫的燃烧热为_____kJ·mol-1。
(7)尾气SO2可以用氨水吸收除去。
已知25℃时,NH3·H2O 的Kb=1.8×10-5,H2SO3:Ka1=1.3×10-2、Ka2=6.2×10-8。
①若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=___________mol/L。
②将SO2 通入该氨水中,当c(OH-)降至1.0×10-7 mol/L时,溶液中的c(SO32-)/c(HSO3-)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子结构及元素周期律的叙述不正确的是( )
A. 原子半径:![]() ,离子半径:r(Na+)<r(O2-)
,离子半径:r(Na+)<r(O2-)
B. 第![]() 族元素碘的两种核素
族元素碘的两种核素![]() 和
和![]() 的核外电子数之差为6
的核外电子数之差为6
C. P和As属于第VA族元素,![]() 的酸性强于
的酸性强于![]() 的酸性
的酸性
D. ![]() 、
、![]() 、
、![]() 三种元素最高价氧化物对应水化物的碱性依次减弱
三种元素最高价氧化物对应水化物的碱性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:

下列叙述正确的是
A. 用溴水可鉴别化合物X和Z B. 化合物Y的分子式为C6H13NO2
C. 化合物Z中含有手性碳原子 D. 1mol化合物Z可以与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,互为同位素的是____________(填序号,下同),互为同系物的是______________,互为同分异构体的是________。
①红磷与白磷
②![]() 与
与![]()
③CH3COOCH3与CH3CH2COOCH3
④
⑤
⑥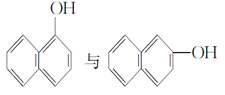
⑦乙醇与二甲醚
(2)按系统命名法给下列有机物命名:
①CH3CH(C2H5)CH(CH3)2: _____________________________________。
② :____________
:____________
(3)A~D四种物质皆为烃类有机物,分子球棍模型分别如下所示,请回答下列问题。

①等物质的量的上述烃,完全燃烧时消耗O2最多的是__________(填字母代号,下同),等质量的上述烃完全燃烧时消耗O2最多的是________。
②在120 ℃,1.01×105 Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是________________。
③B的某种同系物W,分子式为C6H12,且所有碳原子都在同一平面上,则W的结构简式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com