
【题目】用聚光手电筒照射下列分散系,可观察到丁达尔效应的是
A.KOH溶液 B.Fe(OH)3胶体 C.盐酸 D.NaNO3溶液
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ、某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR—→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O72-转移4.8 mol e-,该反应离子方程式为______________。
Ⅱ、酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水;该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(4)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是____________________。
(5)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为__________________________。
(6)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________。
(2)配合物K4Fe(CN)6的中心离子是____________,该离子价电子的基态电子排布图为____________。
(3)lmol HCN分子中含有σ键的数目为____________,HCN分子中碳原子轨道杂化类型是____________,与CN-互为等电子体的阴离子是____________。
(4)K2CO3中阴离子的空间构型为____________,其中碳原子的价层电子对数为____________。
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________(用NA表示阿伏伽德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750 ℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。
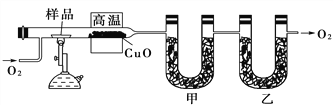
试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?并请说明理由:_________________________________________________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么?
_________________________________________________________。
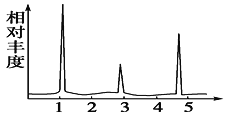
有机物A的核磁
共振氢谱图
(3)将4.6 g有机物A进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质中各元素的原子个数比是________。
(4)经测定,有机物A的核磁共振氢谱示意图如图,则A的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. Si可用来制造半导体材料
B. 用丁达尔效应可以鉴别溶液和胶体
C. 铁制容器可用于常温下贮存、运输浓硫酸
D. SO3溶于水形成的溶液能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,氨气与氟气发生反应:4NH3+3F2→NF3+3NH4F,其中NF3空间结构与NH3相似。下列有关说法错误的是
A. 反应物和生成物均为共价化合物 B. NF3空间结构为三角锥形
C. NF3中只含极性共价键 D. NH4F中既含有离子键又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非血红素铁是食物中铁元素存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物。
(1)Fe2+基态核外电子排布式为________。
(2)C、N、O原子的电负性由大到小的顺序为________。
(3)乙酸分子中C原子轨道杂化类型为________。乙酸的沸点比甲酸甲酯(HCOOCH3)的高,其主要原因是________。
(4)把氯气通入黄血盐(K4[Fe(CN)6])溶液中,得到赤血盐(K3[Fe(CN)6]),写出该变化对应的化学方程式:____________________。
(5)FeO晶胞结构如右图所示,FeO 晶体中Fe2+周围等距离最近的 Fe2+有________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中常见物质的说法不正确的是
A. 医用酒精是中性消毒剂,能使细菌内蛋白质变性而杀菌
B. 火腿中常加入适量NaNO2作防腐剂、抗氧化剂
C. 用灼烧的方法可以区分羊毛衫和涤纶衫
D. 84消毒液与洁厕灵合用能增强消毒效果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com