
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
B.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.标准状况下,11.2L水中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
科目:高中化学 来源: 题型:
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。

①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿渣主要含硫酸钡、氧化铜、氧化铝等(杂质不参加反应),利用矿渣提取金属的工艺流程如图所示(乙、丙、丁、戊均为单质):

回答下列问题:
(1)沉淀①为_____________(填“强”、“弱”或“非”)电解质。
(2)灼烧沉淀②所需要的非玻璃仪器有坩埚、__________、___________、__________。
(3)滤液①的主要成分为___________________________。
(4)滤液①中加入适量盐酸发生的离子方程式为_______________、__________________。
(5)反应①的反应条件是________________________。
(6)电解滤液③时阴极的电极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:

(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是______________________________________。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e-=== CO2 + 6H+
则正极发生的反应是__________;放电时,H+移向电池的______(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-) (填“>”、“=”或“<”),原因是________________________(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于烧杯中,加入250 mL蒸馏水溶解,然后转移至250 mL容量瓶中定容 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | SO42-的检验 | 先滴加BaCl2溶液再滴加HCl溶液生成白色沉淀证明原溶液中有SO42- |
D | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。 | 溶液中一定含有Fe2+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为 ( )
A.1∶1B.2∶1C.3∶1D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
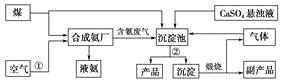
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入![]() 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为![]() 的
的![]() 溶液,生成的沉淀跟加入的
溶液,生成的沉淀跟加入的![]() 溶液的体积关系如图。(横坐标体积单位是
溶液的体积关系如图。(横坐标体积单位是![]() ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求:
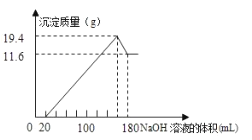
(1)合金中![]() ,
,![]() 的质量_____________
的质量_____________
(2)所用![]() 的物质的量浓度___________
的物质的量浓度___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能。下列说法中不正确的是

A. M极作负极,发生氧化反应
B. 电子流向:M→负载→N→电解质溶液→M
C. N极的电极反应:O2+4H++4e-=2H2O
D. 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com