
| A. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数目大于0.1NA,小于0.2NA | |
| B. | 常温下0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| D. | 19gT35Cl和H37Cl的混合物中所含中子数为10NA |
分析 A.Na2S和Na2O2的摩尔质量均为78g/mol,两种化合物的阳离子与阴离子个数比均为2:1;
B.溶液体积不知不能计算微粒数;
C.标准状况下三氯甲烷不是气体;
D.T35Cl和H37Cl的摩尔质量为38g/mol,质量数=质子数+中子数计算分析.
解答 解:A.Na2S和Na2O2的摩尔质量均为78g/mol,则混合物的总物质的量为 $\frac{7.8g}{78g/mol}$=0.1mol,两种化合物的阳离子与阴离子个数比均为2:1,因此所含有的阴离子的个数为0.1mol×NAmol-1×1=0.1NA,故A错误;
B.溶液体积不知,不能计算氮原子数目,故B错误;
C.标准状况下三氯甲烷不是气体,2.24L CHCl3的物质的量不是0.1mol,故C错误;
D.19gT35Cl和H37Cl的混合物物质的量=$\frac{19g}{38g/mol}$=0.5mol,T35Cl和H37Cl的中子数3-1+35-17=20,1-1+37-17=20,都为20,19gT35Cl和H37Cl的混合物物质的量为0.5mol其中所含中子数为10NA,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件及标况下常见物质的状态,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 改善能源结构,大力发展太阳能、风能等清洁能源 | |
| B. | 推广碳捕集和储存技术,逐步实现二氧化碳零排放 | |
| C. | 推广使用煤液化、气化技术,减少二氧化碳的排放 | |
| D. | 工业废水、生活污水净化处理,减少污染物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
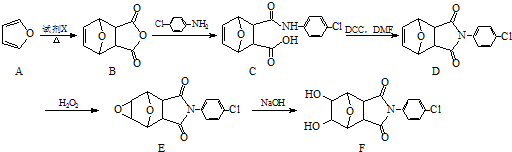
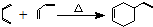 ;②
;②
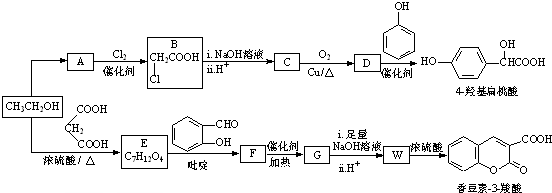
 )、羧基和醚键.(填名称)
)、羧基和醚键.(填名称)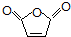 ;D→E的反应类型是氧化反应.
;D→E的反应类型是氧化反应.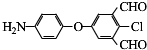 等.
等. )的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当达到化学平衡时,反应物已完全转化为生成物 | |
| B. | 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏 | |
| C. | 当达到化学平衡时,反应混合物中各成分的浓度相等 | |
| D. | 当达到化学平衡时,正逆反应均已停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 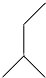 (2-乙基丙烷) (2-乙基丙烷) | B. | CH3CH2CH2CH2OH(1-丁醇) | ||
| C. |  (间二甲苯) (间二甲苯) | D. | CH3C(CH3)=CH2(2-甲基-2-丙烯) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
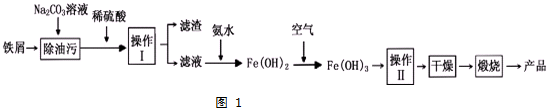
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
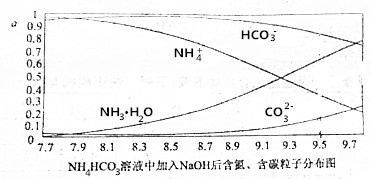
| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
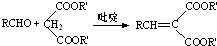 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)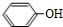 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$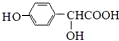 .
.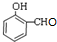 $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$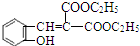 +H2O.
+H2O.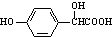 )的同分异构体
)的同分异构体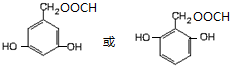 .
.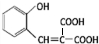 $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$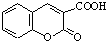 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com