
在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
序号 锌的质量/g 锌的形状 温度/℃ 完全溶解于酸的时间/s
A 2 薄片 5 400
B 2 薄片 15 200
C 2 薄片 25 100
D 2 薄片 30 t1
E 2 薄片 35 50
F 2 颗粒 15 t2
G 2 粉末 15 t3
则下列说法正确的是()
①t1=75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB.
A. ① B. ①② C. 只有② D. 全部正确
考点: 化学反应速率的影响因素.
专题: 化学反应速率专题.
分析: 根据实验序号A、B、C的温度每升高10℃,固体溶解时间变为原来的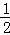 ,即速度为原来的2倍;
,即速度为原来的2倍;
根据固体的反应速率与其表面积大小有关,表面积越大,反应越快,反应速率大小顺序为:粉末>薄片>颗粒;
解答: 解:①由实验序号A、B、C的温度每升高10℃,固体溶解时间变为原来的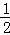 ,即速度为原来的2倍,即v(高温)=v(低温)×
,即速度为原来的2倍,即v(高温)=v(低温)×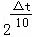 ,所以温度每升高5℃,速度为原来的
,所以温度每升高5℃,速度为原来的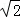 倍,固体溶解时间变为原来的
倍,固体溶解时间变为原来的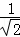 ,故t1=100×
,故t1=100×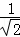 =70.7s,故①错误;
=70.7s,故①错误;
②固体的反应速率与其表面积大小有关,表面积越大,反应越快,反应速率大小顺序为:粉末>薄片>颗粒,溶解相同质量的锌,需要的时间t2>200>t3,故②正确;
③固体的反应速率与其表面积大小有关,表面积越大,反应越快,反应速率大小顺序为:粉末>薄片>颗粒,单位时间内消耗的锌的质量mG>mB>mF,故③错误;
故选:C.
点评: 本题主要考查了温度、固体表面积对化学反应速率的影响,对温度对化学反应速率的影响可通过V(高温)=V(低温)×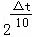 来解答.
来解答.


科目:高中化学 来源: 题型:
下列说法错误的是()
A. 含有共价键的化合物一定是共价化合物
B. 在共价化合物中一定含有共价键
C. 含有离子键的化合物一定是离子化合物
D. 双原子单质分子中的共价健一定是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程能量变化如图所示,下列说法正确的是()
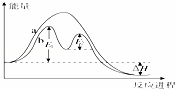
A. 反应过程a有催化剂参与
B. 该反应为放热反应,热效应不等于△H
C. 改变催化剂,可改变该反应的活化能
D. 有催化剂条件下,反应的活化能等于E1+E2
查看答案和解析>>
科目:高中化学 来源: 题型:
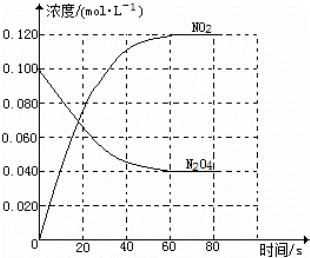
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度的升高,混合气体的颜色变深.
回答下列问题:
(1)反应的△H 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为 mol•L﹣1•s﹣1;反应的平衡常数K1为 .
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•s﹣1的平均速率降低,经10s又达到平衡.
①T 100℃(填“大于”或“小于”),判断理由是 .
②列式计算温度T时反应的平衡常数K2 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
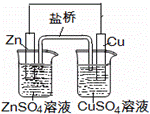
A. 电镀时,通常把待镀的金属制品作阴极
B. 氢氧燃料电池(酸性电解质)中O2通入负极
C. 图中电子由Cu极流向Zn,盐桥中的Cl﹣移向CuSO4溶液
D. 在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
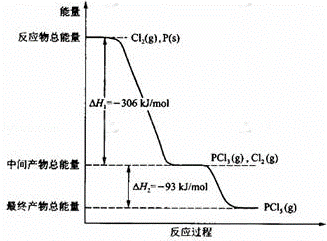
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是: ;
(2)PCl5分解成PCl3和Cl2的热化学方程式是: ;
上述分解反应是一个可逆反应.温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于25%;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2 α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H 3= ,P和Cl2一步反应生成1mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”).
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
U﹣235原子的裂变是目前人类利用核能的主要来源,下列有关 的说法正确的是( )
的说法正确的是( )
|
| A. |
|
|
| B. |
|
|
| C. |
|
|
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某KOH样品中含水7.62%,含K2CO32.23%,含KOH90%.现将1.00g样品加入46.00mL1.00mol/L的盐酸中,过量的酸用1.070mol/LKOH溶液刚好中和.蒸发溶液,蒸发到无水时,可得到固体的质量约为( )
|
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com