
| A. | K>K+ | B. | Na+>Mg2+>Al3+ | C. | Na+>F- | D. | Cl->Na+ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4(aq)滴定H2C2O4(aq)的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液应用式碱滴定管盛装 | |
| C. | 滴定终点时的现象为:最后1滴标准KMnO4(aq)使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色 | |
| D. | 经计算该样品中钙离子浓度为1.000×10-4g•mL-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>d,离子的还原性Y2->Z- | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 原子半径X<W,第一电离能X<W | D. | 电负性Z>Y>W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CHCOO-) | |
| B. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCl)>Ksp(Ag2CrO4),则AgCl的溶解度大于Ag2CrO4 | |
| D. | 醋酸溶液加少量水稀释$\frac{c(C{H}_{3}COOH)}{C({H}^{+})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
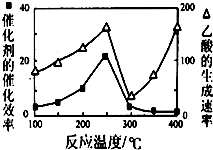 利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NO | B. | 1 mol NO2和0.05 mol O2 | ||
| C. | 2 mol O2 | D. | 0.25 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O的电离平衡常数随着温度升高而减小 | |
| B. | 在0.10 mol•L-1CH3COOH溶液中,加入少量CH3COONa晶体后,溶液的pH减小 | |
| C. | 强酸、强碱和大部分盐类都是强电解质,其他化合物都是弱电解质 | |
| D. | 相同温度下,醋酸溶液的导电能力可能比稀硫酸强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com