
下列解释实际应用的原理表达式中,不正确的是
A.用排饱和食盐水法收集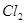 : :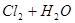  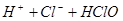 |
B.热的纯碱溶液碱性增强:  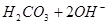 |
C.向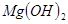 悬浊液中加入 悬浊液中加入 溶液: 溶液: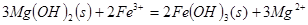 |
D.配制FeCl3溶液时为防止溶液浑浊常加入少量稀盐酸Fe3++3H2O Fe(OH)3+3H+, Fe(OH)3+3H+, |
B
解析试题分析:A. 用排饱和食盐水法收集Cl2,是因为在水中存在可逆反应,Cl2+H2O H++Cl-+HClO,当水中存在Cl-平衡逆向移动,可以减少Cl2的溶解,因此可以用排饱和食盐水的方法收集,正确;B.Na2CO3是强碱弱酸盐水解使溶液显碱性,而盐水解的反应是吸热反应,所以升高温度,盐水解程度增大,溶液的碱性增强,但是盐水解是逐步进行的,因此该表达式错误;C.在Mg(OH)2的悬浊液中存在沉淀溶解平衡,当向该悬浊液中加 入FeCl3溶液时,由于在溶液中c(Fe3+)c3(OH-)>Ksp(Fe(OH)3),所以会形成氢氧化铁沉淀,会发生沉淀转化,正确; D. 配制FeCl3溶液时由于Fe3+水解产生氢氧化铁而使溶液浑浊,所以为抑制水解,防止溶液浑浊常加入少量稀盐酸,正确。
H++Cl-+HClO,当水中存在Cl-平衡逆向移动,可以减少Cl2的溶解,因此可以用排饱和食盐水的方法收集,正确;B.Na2CO3是强碱弱酸盐水解使溶液显碱性,而盐水解的反应是吸热反应,所以升高温度,盐水解程度增大,溶液的碱性增强,但是盐水解是逐步进行的,因此该表达式错误;C.在Mg(OH)2的悬浊液中存在沉淀溶解平衡,当向该悬浊液中加 入FeCl3溶液时,由于在溶液中c(Fe3+)c3(OH-)>Ksp(Fe(OH)3),所以会形成氢氧化铁沉淀,会发生沉淀转化,正确; D. 配制FeCl3溶液时由于Fe3+水解产生氢氧化铁而使溶液浑浊,所以为抑制水解,防止溶液浑浊常加入少量稀盐酸,正确。
考点:考查平衡原理的应用的知识。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:单选题
在温度不变的条件下,在恒容的容器中进行下列反应: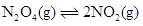 。若
。若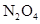 的浓度由
的浓度由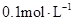 降到
降到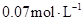 需要15s,那么
需要15s,那么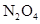 的浓度由
的浓度由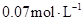 降到
降到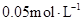 所需的反应时间( )
所需的反应时间( )
| A.等于5s | B.等于10s | C.大于10s | D.小于10s |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把镁带投入盛有盐酸的敞口容器里,下列因素对反应速率有影响的是
①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度
| A.①② | B.③④ | C.①②③④ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)
| A.等于1.369 g·L-1 |
| B.等于2.054 g·L-1 |
| C.在1.369g·L-1和2.054g·L-1之间 |
| D.在2.054g·L-1和4.108g·L-1之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,某一密闭恒容的容器内存在可逆反应A(g)+3B(s)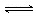 2C(g),可判断其达到化学平衡状态的是
2C(g),可判断其达到化学平衡状态的是
A.当生成C的速率为0时
B.容器内混合气体的密度不随时间而变化
C.单位时间内生成n molA,同时生成3n molB
D.A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是( )
| A.18O只存在于乙酸乙酯中 | B.18O存在于水、乙酸、乙醇以及乙酸乙酯中 |
| C.18O存在于乙酸乙酯、乙醇中 | D.若与丙酸反应生成酯的相对分子质量为102 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应:4A(g)+5B(g)=4C(g)+6D(g)在不同条件下进行,用不同的物质表示其反应速率如下,
则此反应在不同条件下进行最快的是( )。
A.v(A) =2 mol·L-1 ·min-1 B.v(B) =3 mol·L-1 ·min-1
C.v(C) =1 mol·L-1 ·min-1 D.v(D) =2.4 mol·L-1 ·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一个恒温恒容的密闭容器中发生如下反应,2A(g)+ B(s)  C(g)+3D(g),不能说明该反应达到平衡的是( )
C(g)+3D(g),不能说明该反应达到平衡的是( )
| A.气体总质量不变 | B.混合气体密度不变 |
| C.反应物B的浓度不变 | D.混合气体平均相对分子质量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为探究锌与稀盐酸反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是
| A.加入铜粉,v(H2)增大 |
| B.加入NaHSO4固体,v(H2)不变 |
| C.加入水,锌不与水反应,v(H2)不变 |
| D.加入NaCl固体,会增大Cl-浓度,使v(H2)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com