
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

滤液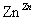
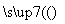 滤液
滤液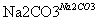
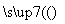 滤饼
滤饼 ZnO
ZnO
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
答案 (1)Fe2+和Mn2+ MnO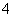 +3Fe2++7H2O===3Fe(OH)3↓+MnO2↓+5H+、2MnO
+3Fe2++7H2O===3Fe(OH)3↓+MnO2↓+5H+、2MnO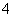 +3Mn2++2H2O===5MnO2↓+4H+ 铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质
+3Mn2++2H2O===5MnO2↓+4H+ 铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质
(2)置换反应 镍
(3)取少量水洗液于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净
(4)1
解析 从分析整个流程图入手,明确每步发生的反应,从而解决相关问题。
(1)在反应②中,通过调节溶液的pH,高锰酸钾能将溶液中的Fe2+氧化为Fe3+,将Mn2+氧化为MnO2而除去;若溶液的pH过低,Fe2+、Mn2+将很难生成沉淀而除去。
(2)第一次过滤后的滤液中含有的阳离子有Zn2+、Ni2+、H+等,加入锌后可将Ni置换出来,故滤渣中还含有金属镍。
(3)反应④生成的沉淀为ZnCO3,同时生成Na2SO4,若沉淀未洗涤干净,洗涤液中应含有SO 和Na+,故只要对洗涤液中是否含有SO
和Na+,故只要对洗涤液中是否含有SO 进行检验即可。
进行检验即可。
(4)煅烧过程中ZnCO3、Zn(OH)2均发生分解反应生成ZnO,根据关系式ZnCO3·xZn(OH)2~(x+1)ZnO,可得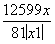 =
=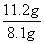 ,故x=1。
,故x=1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下。

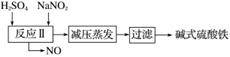
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题。
(1)加入少量NaHCO3的目的是调节pH,使溶液中的______沉淀,该工艺中“搅拌”的作用是__________。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)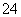 。该水解反应的离子方程式为__________________。
。该水解反应的离子方程式为__________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A.氯水 B.KSCN溶液
C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬烯是一种食用香料,其结构简式如图所示。
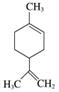
下列有关柠檬烯的分析正确的是( )
A.它的一氯代物有8种
B.它的分子中所有的碳原子一定在同一平面上
C.它和丁基苯(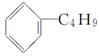 )互为同分异构体
)互为同分异构体
D.一定条件下,它分别可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KxCuy(C2O4)z·nH2O。通过下述实验确定该晶体的组成。(已知:MnO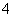 在酸性条件下,加热能分解为O2,同时生成Mn2+。)
在酸性条件下,加热能分解为O2,同时生成Mn2+。)
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO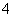 +5C2O
+5C2O +16H+===2Mn2++8H2O+10CO2↑。
+16H+===2Mn2++8H2O+10CO2↑。
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为I2+2S2O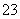 ===2I-+S4O
===2I-+S4O 。
。
(1)步骤b中生成白色沉淀的离子方程式:________________________________________________________________________。
(2)步骤b中“将溶液充分加热”的目的是________________________________________________________________________。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n(C2O )(写出计算过程)
)(写出计算过程)
________________________________________________________________________。
②计算样品中n(Cu2+)(写出计算过程)
________________________________________________________________________。
③根据________原理可求出n(K+),再依据________原理求得n(H2O)。
④该样品晶体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可产生它。下列有关叙述中错误的是( )
A.“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH+3H++NO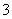 ===Cu2++NO↑+2H2O
===Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2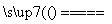 CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O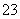 将转化为( )
将转化为( )
A.S2- B.S C.SO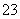 D.SO
D.SO
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
 CaCl2固体 30%的H2O2
CaCl2固体 30%的H2O2











NH3 副产品 产品
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________________________________________________________________________
________________________________________________________________________。
(2)检验“水洗”是否合格的方法是________。
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①________________________________________________________________________;
②________________________________________________________________________。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O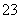 ===2I-+S4O
===2I-+S4O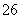 )
)
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
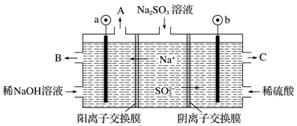
(1)图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
(2)SO 放电的电极反应式为____________。
放电的电极反应式为____________。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com