
【题目】下列说法正确的是( )。
A. 增大反应体系的压强,反应速率不一定增大
B. 增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大
C. 活化分子的碰撞都是有效碰撞
D. 加入催化剂加快了反应速率,改变了反应吸收或放出的热量
科目:高中化学 来源: 题型:
【题目】实验室通常采用粗锌与稀硫酸制氢气,因此制氢废液中含有大量的硫酸锌,同时含少量硫酸亚铁、硫酸铅等杂质。由制氢废液制备硫酸锌晶体(ZnSO4·7H2O)的流程如下:
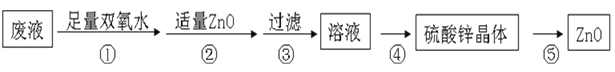
下列说法不正确的是
A. 步骤①,涉及的化学反应为:2Fe2++H2O2+2H+=2Fe3++2 H2O
B. 步骤②,加入适量ZnO的目的是:调节溶液pH,沉淀Fe3+
C. 步骤④,涉及的操作有:蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D. 步骤⑤,产物一定是:ZnO和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
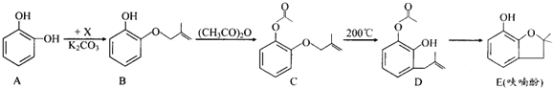
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案,方案一如下图所示,方案二如下图所示。请回答下列问题(本题不考虑N2O4存在产生的影响):
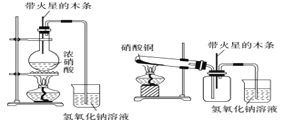
(1) 浓硝酸受热分解的化学方程式是______________。
(2) 方案一实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是_________________________________。
(3) 硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是_____________。
(4) 方案二实验当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是____________ 。
(5) 为了更直接地说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中数据合理的是
A.用10 mL 量筒量取5.2 mL盐酸
B.用广泛pH试纸测得某溶液的pH值为12.5
C.用托盘天平称取25.12gNaCl固体
D.用100 mL容量瓶配制50mL0.1 mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)己达到平衡状态的是( )
C(g)+D(g)己达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值
⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1 : 1
A. ①③④⑤ B. ①③④⑤⑧⑨ C. ①②③④⑤⑦ D. ①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制450ml 0.2mol·L-1 Na2CO3溶液.请回答下列问题。
(1)托盘天平天平称取无水碳酸钠固体的质量为__________g。
(2)需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和_____________。
(3)试分析下列操作对所配溶液的浓度有何影响(填“偏高”,“偏低”或“无影响”)。
① 未洗涤烧杯和玻璃棒,使所配溶液浓度_________;
② 定容时俯视刻度线,使所配溶液浓度___________;
③ 摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是
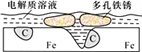
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com