
【题目】Ⅰ.碘酸钾(KIO3)是一种白色或无色固体,可溶于水,具有较强的氧化性。常添加于食盐中用以防治碘缺乏病。已知在某反应体系中存在以下几个物质: KIO3、K2SO4、KI、I2、H2SO4、H2O。
(1)书写并配平该反应方程式,并标出电子转移的方向和数目:_________________;
(2)下列说法中正确的是_________。
A.I2是非电解质 B.K2SO4溶液的导电能力一定比KI溶液的强
C.H2SO4没有参加氧化还原反应 D.氧化产物和还原产物都是I2
Ⅱ.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用,实验室可用KClO3通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
试回答下列问题。
(3)该反应中还原产物的化学式是_________;被氧化的元素是_________。
(4)生成标况下4.48LCO2,电子转移数是_______________。
(5)ClO2和Cl2均能将电镀废水中的CN 反应为无毒的物质,自身反应后均生成Cl,此过程说明ClO2和Cl2均具有_________ (填“氧化”或“还原”)性。处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的_________倍。
【答案】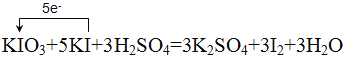 CD ClO2 C 0.2NA 氧化 2.5
CD ClO2 C 0.2NA 氧化 2.5
【解析】
(1)KIO3具有较强的氧化性,KI具有还原性,二者在酸性条件下发生氧化还原反应,生成单质碘;
(2)A.单质既不是电解质,也不是非电解质;B.溶液的导电性与离子浓度有关;C.根据硫酸中是否有元素的化合价发生变化判断;D.根据元素的化合价判断;
(3)2KClO3+H2C2O4+H2SO4═K2SO4+2ClO2↑+2H2O+2CO2↑,反应中,KClO3中Cl元素的化合价由+5价降低为+4价,H2C2O4中C元素的化合价升高,据此分析解答(3)和(4);
(5)Cl2和ClO2被还原后均生成氯离子,根据转移的电子数相等分析计算。
Ⅰ.(1)KIO3具有较强的氧化性,KI具有还原性,二者在酸性条件下发生氧化还原反应,生成单质碘,反应的方程式为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;反应中KIO3中I元素由+5价降低为0价,KI中I元素由-1价升高为0价,转移5个电子,电子转移的方向和数目用单线桥表示为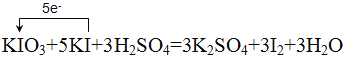 ,故答案为:
,故答案为: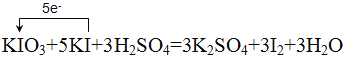 ;
;
(2)A.单质既不是电解质,也不是非电解质,所以I2不是非电解质,故A错误;B.溶液的浓度不知道,无法判断K2SO4溶液与KI溶液的导电性强弱,故B错误;C.反应中生成了硫酸盐,H2SO4中元素的化合价均没有变化,没有参加氧化还原反应,故C正确;D.KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;反应中KIO3中I元素由+5价降低为0价,KI中I元素由-1价升高为0价,反应中只有I元素的化合价发生了变化,氧化产物和还原产物都是I2,故D正确;故答案为:CD;
Ⅱ.(3)反应中,KClO3中Cl元素的化合价由+5价降低为+4价,被还原,则ClO2是还原产物,H2C2O4中C元素的化合价升高,则C元素被氧化,故答案为:ClO2;C;
(4)2KClO3+H2C2O4+H2SO4═K2SO4+2ClO2↑+2H2O+2CO2↑,KClO3中Cl元素的化合价由+5价降低为+4价,反应中转移电子数为2,即生成2mol CO2转移2mol电子;标况下4.48LCO2的物质的量为![]() =0.2mol,则电子转移数为0.2NA,故答案为:0.2NA;
=0.2mol,则电子转移数为0.2NA,故答案为:0.2NA;
(5)ClO2和Cl2均容易得电子,具有氧化性;有每摩尔Cl2反应生成氯离子得到2mol电子,而每摩尔ClO2反应生成氯离子得到5mol电子,则处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的![]() =2.5倍,故答案为:氧化;2.5。
=2.5倍,故答案为:氧化;2.5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解H2和O2,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是( )

A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:H2-2e-=2H+
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
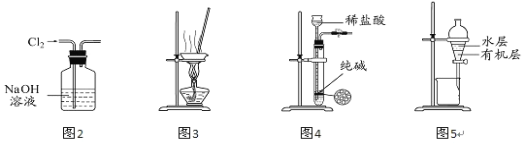
A.用图2所示装置除去Cl2中含有的少量HCl
B.用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图4 所示装置制取少量纯净的CO2气体
D.用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况下,11.2LCH2Cl2中所含C-Cl键的数目与22.4LHF中所含F原子数目相等
B. 1LpH=13的NaOH溶液中含有OH-的数目一定为0.1NA
C. 1mol过氧化钠分别与足量CO2、SO2反应,转移的电子数均为2NA
D. 10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。下列有关说法正确的是

A. 制取NaHCO3的反应是利用其溶解度比较小
B. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)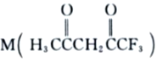 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。
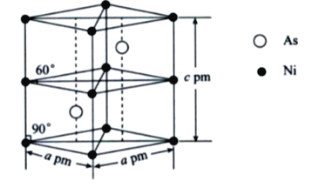
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途。完成下列填空:
(1)硫原子核外电子排布式____,钠离子的核外有___种能量不同的电子。
(2)SO2分子构型为“V型”,则SO2是___(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气___(选填“大”、“小”、“一样”)。
(3)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:___S2O32-+___Cl2+___H2O→___SO42-+___Cl-+___H+
配平该反应方程式,若反应中生成2molSO42-,则转移电子____mol。
(4)Na2S又称臭碱、硫化碱,用离子方程式说明Na2S溶液呈碱性的原因___。
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是___(填微粒符号)。在Na2SO3溶液中各微粒浓度等式关系正确的是____。

a.c(Na+)=c(SO32-)+2c(HSO3-)+2c(H2SO3)
b.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
c.c(OH-)=c(HSO3-)+c(H+)+c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeOCr2O3、SiO2等)制备,制备流程如图所示:

已知:a.步骤①的主要反应为:2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+ ![]() Cr2O72-+H2O,下列说法正确的是
Cr2O72-+H2O,下列说法正确的是
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8L CO2共转移7mol电子
C. 步骤④若调节滤液2的pH使之变小,则有利于生成Cr2O72—
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7溶解度小于Na2Cr2O7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com