
我国科技创新成果斐然,下列成果中获得诺贝尔奖的是
A.徐光宪建立稀土串级萃取理论
B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂
D.侯德榜联合制碱法
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体
D.AB3型的分子立体构型必为平面三角形
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省资阳市高二下学期期末化学试卷(解析版) 题型:实验题
某同学用中和滴定的方法测定混有少量Na2CO3的NaOH固体中NaOH的含量,准确称取2.0 g样品配制成200 mL溶液,然后分三次各取20.00 mL溶液于三个洁净的锥形瓶中,分别加入过量BaCl2溶液和1~2滴指示剂,用浓度为0.2000 mol·L-1的盐酸标准液进行滴定。
(1)滴定时应选用____作指示剂;到达滴定终点的实验现象是____。
(2)下列操作会导致烧碱样品中NaOH含量测定值偏高的是____。
A.锥形瓶未用待测液润洗 |
B.酸式滴定管未用标准液润洗 |
C.在滴定前有气泡,滴定后气泡消失 |
D.滴定前平视读数,滴定结束俯视读数 |
E.滴定终点前加水清洗锥形瓶
F.指示剂变色后立即读数
(3)实验相关数据记录如下:
实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
初读数 | 末读数 | ||
1 | 20.00 | 0.60 | 20.62 |
2 | 20.00 | 0.80 | 20.78 |
3 | 20.00 | 0.20 | 20.90 |
依据表中数据,计算样品中NaOH的质量分数____。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(天津卷精编版) 题型:选择题
下列对氨基酸和蛋白质的描述正确的是( )
A.蛋白质水解的最终产物是氨基酸
B.氨基酸和蛋白质遇重金属离子均会变性
C.α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽
D.氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(北京卷精编版) 题型:选择题
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
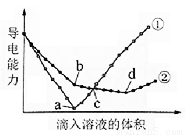
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(新课标3卷精编版) 题型:填空题
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10?3mol·L?1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42? | SO32? | NO3? | NO2? | Cl? |
c/(mol·L?1) | 8.35×10?4 | 6.87×10?6 | 1.5×10?4 | 1.2×10?5 | 3.4×10?3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
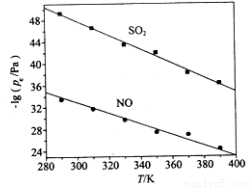
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2?+2SO32?===2SO42?+Cl?的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH? (aq) ===SO32? (aq)+H2O(l) ΔH1
ClO? (aq)+SO32? (aq) ===SO42? (aq)+Cl? (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42?(aq)ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO? (aq) +2OH? (aq) === CaSO4(s) +H2O(l) +Cl? (aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(新课标3卷精编版) 题型:选择题
下列说法错误的是( )
A.乙烷室温下能与浓盐酸发生取代反应
B.乙烯可以用作生产食品包装材料的原料
C.乙醇室温下在水中的溶解度大于溴乙烷
D.乙酸与甲酸甲酯互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(新课标1卷精编版) 题型:实验题
[化学——选修2:化学与技术]高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“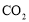 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③“电解法”和“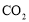 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L?1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为 (列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(四川卷精编版) 题型:选择题
下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com