
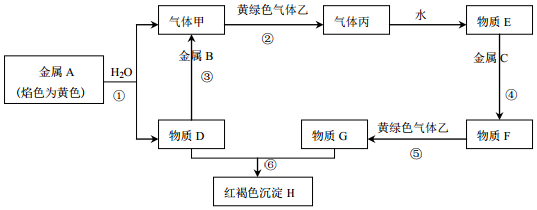
分析 金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2,判断C为Fe,据此答题.
解答 解:(1)依据以上分析,B为Al,乙为Cl2,E为盐酸;
故答案为:Al;Cl2;盐酸;
(2)反应⑤是氯化亚铁和氯气反应生成氯化铁的反应:2FeCl2+Cl2=2FeCl3 ;
反应⑥是氢氧化钠和氯化铁反应的化学方程式为:3NaOH+FeCl3=Fe(OH)3↓+3NaCl;
故答案为:2FeCl2+Cl2=2FeCl3 ;3NaOH+FeCl3=Fe(OH)3↓+3NaCl;
(3)①反应是钠和水的反应,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
反应③是氢氧化钠和铝反应生成氢气和偏铝酸钠,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查了物质转化关系的分析推断,物质性质的应用主要考查常见单质及其化合物的性质应用,题目较简单.


科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| a.取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| b.取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| c.取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| d.取少量该溶液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| e.取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)<c(H+)<c(NH4+)<c(SO42-) | B. | c(OH-)<c(NH4+)<c(SO42-)<c(H+) | ||
| C. | c(SO42-)+c(OH-)>c(NH4+)+c(H+) | D. | c(SO42-)+c(OH-)=c(NH4+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
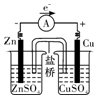
| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量逐渐减少 | ||
| C. | 电流方向从锌片经导线流向铜片 | D. | 铜离子在铜片表面被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量新制氯水 | B. | 加入一定量的小苏打溶液 | ||
| C. | 加入一定量的氢氧化钡固体 | D. | 加入一定量的Na2SO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用增大臭氧浓度来改善空气质量 | |
| B. | 利用地热、潮汐等能源替代化石燃料 | |
| C. | 使用可降解塑料减少“白色污染” | |
| D. | 选用不含氮、磷的洗涤剂防止蓝藻污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com