
ЁОЬтФПЁПбЧЯѕЫс(HNO2)ЪЧвЛдЊШѕЫсЃЌВЛЮШЖЈЃЌжЛФмДцдкгкНЯЕЭЮТЖШЕФЯЁШмвКжаЁЃЪвЮТЪБЃЌбЧЯѕЫс(HNO2)ЕФЕчРыЦНКтГЃЪ§Ka=5.1ЁС10-4ЃЌH2CO3ЕФЕчРыЦНКтГЃЪ§Ka1=4.2ЁС10-7ЁЂKa2=5.61ЁС10-11ЁЃбЧЯѕЫсМАЦфбЮдкЪЕбщКЭЙЄвЕЩњВњжагаживЊгІгУЁЃЧыЛиД№ЃК
(1)дкЫсадЬѕМўЯТЃЌNaNO2гыKIАДЮяжЪЕФСП1ЉU1ЧЁКУЭъШЋЗДгІЃЌIЃБЛбѕЛЏЮЊI2ЃЌаДГіИУЗДгІЕФРызгЗНГЬЪН________________ЁЃ
(2)NaNO2ШмвКГЪ_____ад(ЬюЁАЫсЁБЁАМюЁБЛђЁАжаЁБ)ЃЌдвђЪЧ________(гУРызгЗНГЬЪНБэЪО)ЁЃвЊЕУЕНЮШЖЈHNO2ШмвКЃЌПЩвдЭљРфЖГЕФХЈNaNO2ШмвКжаМгШыЛђЭЈШыФГжжЮяжЪЃЌЯТСаЮяжЪВЛЪЪКЯЪЙгУ______(ЬюађКХ)ЁЃ
a.ЯЁH2SO4 b.CO2 c.SO2
(3)ШєгУЕчНтЗЈНЋЗЯЫЎжаNO2ЃзЊЛЛЮЊN2Г§ШЅЃЌN2НЋдк__________(ЬюЕчМЋУћГЦ)ЩњГЩЁЃ
(4)ЯђКЌ1 mol Na2CO3ЕФШмвКжаМгШы1 mol HNO2КѓЃЌc(CO32-)ЁЂc(HCO3-)ЁЂc(NO2Ѓ)гЩДѓЕНаЁЕФЫГађЮЊ________________ЁЃ
(5)25ЁцЪБЃЌгУ0.100molL-1NaOHШмвКЕЮЖЈ20.0mLФГХЈЖШЕФHNO2ШмвКЃЌШмвКЕФpHгыNaOHШмвКЬхЛ§(V)ЕФЙиЯЕШчЭМЫљЪОЃЌ(дкИУЬѕМўЯТHNO2ВЛЗжНт)

вбжЊЃКMЕуЖдгІШмвКжаЃЌc(OHЃ)=c(H+)+c(HNO2)ЁЃдђЃК
ЂйдШмвКжаc(HNO2)ЮЊ_________ЁЃ
ЂкЯТСаЙигкNЕуЖдгІШмвКЕФЫЕЗЈе§ШЗЕФЪЧ______(ЬюбЁЯюзжФИ)ЁЃ
A.ШмжЪжЛгаNaNO2
B.ЫЎЕчРыГіРДЕФc(H+)=1ЁС10-7 molL-1
C.ШмвКжаЃКc(Na+)ЃМc(OH-)
D.ШмвКжаРызгХЈЖШЃКc(Na+)= c(NO2-)
ЁОД№АИЁП4H+ + 2NO2Ѓ+ 2IЃ=I2 + 2NOЁќ+ 2H2O Мю NO2Ѓ+H2OOHЃ+ HNO2 bc вѕМЋ c(NO2Ѓ)> c(HCO3-) > c(CO32-) 0.110mol/L BD
ЁОНтЮіЁП
(1)ИљОнбѕЛЏЛЙдЗДгІжаЕУЪЇЕчзгЪиКуХаЖЯКЌNВњЮяЃЌНјЖјЪщаДРызгЗНГЬЪНЃЛ
(2)ИљОнИДЗжНтЗДгІжаЧПЫсжЦШѕЫсЕФдРэвдМАбѕЛЏЛЙдЗДгІЕФдРэХаЖЯЃЛ
(3)ЕчНтГижаЃЌвѕМЋЗЂЩњЕУЕчзгЕФЛЙдЗДгІЃЌбєМЋЗЂЩњЪЇЕчзгЕФбѕЛЏЗДгІЃЛ
(4)ЪзЯШХаЖЯЖўепЗДгІЕФВњЮяЃЌдйНсКЯдНШѕдНЫЎНтЕФдРэЗжЮіЃЛ
(5)ЂйИљОнMЕуЖдгІШмвКжаЃЌc(OHЃ)=c(H+)+c(HNO2)ЃЌХаЖЯMЕуЧЁКУЩњГЩNaNO2ЃЌОнДЫМЦЫуc(HNO2)ЃЛ
ЂкNЕуШмвКЯджаадЃЌNaOHВЛзуЃЌHNO2гаЪЃгрЃЌШмжЪЮЊNaNO2ЁЂHNO2ЃЌОнДЫЗжЮіНтД№ЁЃ
(1)IЃБЛбѕЛЏЮЊI2ЪБЃЌ1mol IЃЪЇЕчзг1molЃЌNaNO2жаNдЊЫиЛЏКЯМлЪЧ+3МлЃЌгЩгкдкЫсадЬѕМўЯТЃЌNaNO2гыKIАДЮяжЪЕФСП1ЉU1ЧЁКУЭъШЋЗДгІЃЌгЩЕУЪЇЕчзгЪиКуПЩжЊ1molNaNO2ЕУЕчзг1molЃЌдђNдЊЫиЛЏКЯМлгІНЕЕЭЮЊ+2МлЃЌдђВњЮяжаКЌЕЊЕФЮяжЪЮЊNOЃЌХфЦНИУРызгЗНГЬЪНЮЊ4H+ + 2NO2Ѓ+ 2IЃ=I2 + 2NOЁќ+ 2H2OЃЛЙЪД№АИЮЊЃК4H+ + 2NO2Ѓ+ 2IЃ=I2 +2NOЁќ+2H2OЃЛ
(2)NaNO2ЮЊЧПМюШѕЫсбЮЃЌNO2ЃЗЂЩњЫЎНтNO2Ѓ+H2OOHЃ+ HNO2ЃЌЪЙШмвКГЪМюадЃЛвбжЊЪвЮТЪБЃЌбЧЯѕЫс(HNO2)ЕФЕчРыЦНКтГЃЪ§Ka=5.1ЁС10-4ЃЌH2CO3ЕФЕчРыЦНКтГЃЪ§Ka1=4.2ЁС10-7ЃЌдђЫсадЃКHNO2ЃОH2CO3ЃЌИљОнЧПЫсжЦШѕЫсЕФдРэПЩжЊЃЌNaNO2ЁЂЖўбѕЛЏЬМЁЂЫЎВЛФмЗДгІЩњГЩHNO2ЃЛгЩ(1)жЊдкЫсадЬѕМўЯТЃЌNaNO2ФмНЋIЃбѕЛЏЮЊI2ЃЌдђХЈNaNO2ШмвКжаЭЈШыЖўбѕЛЏСђЪБЃЌNaNO2ФмНЋЖўбѕЛЏСђбѕЛЏЃЌдђЮоЗЈЕУЕНHNO2ЃЛМгШыЯЁH2SO4ЃЌЗЂЩњИДЗжНтЗДгІЩњГЩHNO2ЃЛЙЪД№АИЮЊЃКМюЃЛNO2Ѓ+H2OOHЃ+ HNO2ЃЛbcЃЛ
(3)гУЕчНтЗЈНЋЗЯЫЎжаNO2ЃзЊЛЛЮЊN2Г§ШЅЃЌNдЊЫиЛЏКЯМлНЕЕЭЃЌЕУЕчзгЃЌИљОнЕчНтГиЕФдРэЃЌвѕМЋЗЂЩњЕУЕчзгЕФЛЙдЗДгІЃЌдђN2НЋдквѕМЋЩњГЩЃЛЙЪД№АИЮЊЃКвѕМЋЃЛ
(4)ЫсадЃКHNO2ЃОH2CO3ЃЌдђЯђКЌ1 mol Na2CO3ЕФШмвКжаМгШы1 mol HNO2ЃЌЗЂЩњЗДгІЃКNa2CO3+ HNO2=NaHCO3+ NaNO2ЃЌдђШмжЪБфЮЊ1mol NaHCO3КЭ1molNaNO2ЃЌгЩгкЫсадЃКHNO2ЃОH2CO3ЃЌИљОндНШѕдНЫЎНтдРэжЊЃЌNO2ЃЕФЫЎНтГЬЖШБШHCO3ЃЕФЫЎНтГЬЖШаЁЃЌЧвШѕРызгЕФЫЎНтЪЧЮЂШѕЕФЃЌHCO3ЃЕФЕчРыЪЧЮЂШѕЕФЃЌдђc(CO32-)ЁЂc(HCO3-)ЁЂc(NO2Ѓ)гЩДѓЕНаЁЕФЫГађЮЊc(NO2Ѓ)>c(HCO3Ѓ) > c(CO32Ѓ)ЃЛЙЪД№АИЮЊЃКc(NO2Ѓ)>c(HCO3Ѓ) > c(CO32Ѓ)ЃЛ
(5)ЂйвбжЊЃКMЕуЖдгІШмвКжаЃЌc(OHЃ)=c(H+)+c(HNO2)ЃЌдђMЕуЧЁКУЩњГЩNaNO2ЃЌгЩДЫПЩжЊЃЌ22mL 0.100molL-1NaOHгы20.0mL HNO2ШмвКЧЁКУЗДгІЃЌдђПЩЕУc(NaOH)V(NaOH)=c(HNO2)V(HNO2)ЃЌ0.022LЁС0.100molL-1=0.020Lc(HNO2)ЃЌНтЕУc(HNO2)=0.110mol/LЃЛЙЪД№АИЮЊЃК0.110mol/LЃЛ
ЂкNЕуШмвКЯджаадЃЌNaOHВЛзуЃЌHNO2гаЪЃгрЃЌШмжЪЮЊNaNO2ЁЂHNO2ЃЌ
A. ШмжЪЮЊNaNO2ЁЂHNO2ЃЌAЯюДэЮѓЃЛ
B. NЕуШмвКЯджаадЃЌЫЎЕчРыГіРДЕФc(H+)=1ЁС10-7 molL-1ЃЌBЯюе§ШЗЃЛ
C. NЕуШмвКЯджаадЃЌШмжЪЮЊNaNO2ЁЂHNO2ЃЌc(Na+)дЖДѓгкc(OH-)ЃЌCЯюДэЮѓЃЛ
D. NЕуШмвКЯджаадЃЌгЩЕчКЩЪиКуЃК


 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтЕўЕЊЫс(HN3)КЭФЊЖћбЮ(NH4)2SO4ЁЄFeSO4ЁЄ6H2OЪЧСНжжГЃгУдСЯЁЃ
ЃЈ1ЃЉАБЕўЕЊЫсвзШмгкЫЎЃЌ25ЁцЪБЃЌИУЫсЕФЕчРыГЃЪ§ЮЊKa=10ЁС10-5
ЂйЧтЕўЕЊЫсдкЫЎШмвКжаЕФЕчРыЗНГЬЪНЮЊ________________________________
Ђк0.2mol/LЕФHN3ШмвКгы0.1mol/LЕФNaOHШмвКЕШЬхЛ§ЛьКЯКѓЃЌЛжИДЕН25Ёц,ЛьКЯШмвКжаИїРызгКЭHN3ЗжзгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ__________________________ЁЃ
ЂлвбжЊTЁцЪБЃЌKsp(CuN3)=5.0ЁС10-9,Ksp(Cu2S)=2.5ЁС10-48,дђЯрЭЌЮТЖШЯТЃЌ2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)ИУЗДгІе§ЗДгІЗНЯђ_________(ЁАФмЁБЛђЁАВЛФмЁБ)НјааЛљБОГЙЕзЃЌЧыЭЈЙ§МЦЫуЫЕУї_________________________ЁЃ
Cu2S(s)+2N3-(aq)ИУЗДгІе§ЗДгІЗНЯђ_________(ЁАФмЁБЛђЁАВЛФмЁБ)НјааЛљБОГЙЕзЃЌЧыЭЈЙ§МЦЫуЫЕУї_________________________ЁЃ
ЃЈ2ЃЉдкFeSO4ШмвКжаЃЌМгШы(NH4)2SO4ЙЬЬхПЩжЦБИФЊЖћбЮОЇЬхЃЌЮЊСЫВтЖЈВњЦЗДПЖШЃЌГЦШЁagВњЦЗШмгкЫЎЃЌХфжЦГЩ500mLШмвКЃЌгУХЈЖШЮЊcmol/LЕФЫсадИпУЬЫсМиШмвКЕЮЖЈЃЌУПДЮЫљШЁД§ВтвКЬхЛ§ОљЮЊ25.00mLЃЌЪЕбщНсЙћМЧТМШчЯТЃК(вбжЊФЊЖћбЮЕФЗжзгСПЮЊ392)
ЪЕбщДЮЪ§ | ЕквЛДЮ | ЕкЖўДЮ | ЕкШ§ДЮ |
ЯћКФKMnO4ШмвКЬхЛ§/mL | 25.52 | 25.02 | 24.98 |
ЕЮЖЈжеЕуЕФЯжЯѓЪЧ________________ЃЌЭЈЙ§ЪЕбщЪ§ОнЃЌМЦЫуИУВњЦЗЕФДПЖШЮЊ_________(гУКЌзжФИaЁЂcЕФЪНзгБэЪО)ЁЃЩЯБэЕквЛДЮЪЕбщжаМЧТМЪ§ОнУїЯдДѓгкКѓСНДЮЃЌЦфдвђПЩФмЪЧ_________ЁЃ
AЃЎЕквЛДЮЕЮЖЈЪБЃЌзЖаЮЦПгУД§зАвКШѓЯД
BЃЎИУЫсадИпУЬЫсМиБъзМвКБЃДцЪБМфЙ§ГЄЃЌВПЗжБфжЪ
CЃЎЕЮЖЈЧАЫсЪНЕЮЖЈЙмжаМтзьДІгаЦјХнЃЌЕЮЖЈНсЪјКѓЦјХнЯћЪЇ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
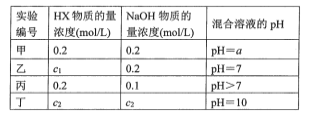
ЁОЬтФПЁПГЃЮТЯТЃЌНЋФГвЛдЊЫсHXКЭNaOHШмвКЕШЬхЛ§ЛьКЯЃЌСНжжШмвКЕФХЈЖШКЭЛьКЯКѓЫљЕУШмвКЕФpHШчЯТБэЃК
ЧыЛиД№ЃК
(1)ВЛПМТЧЦфЫћзщЕФЪЕбщНсЙћЃЌЕЅДгМззщЧщПіЗжЮіЃЌШєa ___7(ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)ЃЌдђHXЮЊЧПЫсЃЛШєa ____ 7ЃЈЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЉЃЌдђHXЮЊШѕЫсЁЃ
(2)дкввзщЛьКЯШмвКжаРызгХЈЖШc(X-)гыc(Na+)ЕФДѓаЁЙиЯЕЪЧ____ЁЃ
A.ЧАепДѓ BЃЎКѓепДѓ CЃЎЖўепЯрЕШ DЃЎЮоЗЈХаЖЯ
(3)ДгБћзщЪЕбщНсЙћЗжЮіЃЌHXЪЧ___ ЫсЃЈЬюЁАЧПЁБЛђЁАШѕЁБЃЉЁЃ
(4)ЖЁзщЪЕбщЫљЕУЛьКЯШмвКжагЩЫЎЕчРыГіЕФc(OH-)=__mol/LЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк1200ЁцЪБЃЌЬьШЛЦјЭбСђЙЄвежаЛсЗЂЩњЯТСаЗДгІ
ЂйH2S(g)+![]() O2(g)=SO2(g)+H2O(g) ЁїH1
O2(g)=SO2(g)+H2O(g) ЁїH1
Ђк2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ЁїH2
S2(g)+2H2O(g) ЁїH2
ЂлH2S(g)+![]() O2(g)=S(g)+H2O(g) ЁїH3
O2(g)=S(g)+H2O(g) ЁїH3
Ђм2S(g) =S2(g) ЁїH4
дђЁїH4ЕФе§ШЗБэДяЪНЮЊЃЈ ЃЉ
A. ЁїH4=2/3ЃЈЁїH1+ЁїH2-3ЁїH3ЃЉ
B. ЁїH4=2/3ЃЈ3ЁїH3-ЁїH1-ЁїH2ЃЉ
C. ЁїH4=3/2ЃЈЁїH1+ЁїH2-3ЁїH3ЃЉ
D. ЁїH4=3/2ЃЈЁїH1-ЁїH2-3ЁїH3ЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБэЪіе§ШЗЕФЪЧ
A.ИжЬњЮќбѕИЏЪДжаЕФе§МЋЗДгІЃК4OH 4e-=2H2O +O2Ёќ
B.ЙЄвЕЩЯгУЕчНтЗЈжЦУОЃКMgCl2(ШлШк)![]() Mg+Cl2Ёќ
Mg+Cl2Ёќ
C.ЪЙpHЪджНЯдРЖЩЋЕФШмвКжаЃКNaЃЋЁЂMg2ЃЋЁЂClOЃЁЂHSO3-ФмДѓСПЙВДц
D.![]() ЃН0.1 molЁЄLЃ1ЕФШмвКжаЃКNaЃЋЁЂHCO3-ЁЂKЃЋЁЂNO3-ФмДѓСПЙВДц
ЃН0.1 molЁЄLЃ1ЕФШмвКжаЃКNaЃЋЁЂHCO3-ЁЂKЃЋЁЂNO3-ФмДѓСПЙВДц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛьКЯШмвКжаЃЌИїРызгХЈЖШЕФДѓаЁЫГађе§ШЗЕФЪЧ
A. 10L0.1molЁЄL-1АБЫЎгы10L0.1molЁЄL-1бЮЫсЛьКЯЃК[Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1molЁЄL-1NH4ClШмвКгы5mL0.2molЁЄL-1NaOHШмвКЛьКЯЃК[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1molЁЄL-1CH3COOHШмвКгы5mL0.2molЁЄL-1NaOHШмвКЛьКЯЃК[Na+]=[CH3COO-]>[OH-]>[H+]
D. 10mL0.5molЁЄL-1CH3COONaШмвКгы6mL1molЁЄL-1бЮЫсЛьКЯЃК[Cl-]>[Na+]>[OH-]>[H+]
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈВЛФмгУРеЯФЬиСадРэНтЪЭЕФЪЧ(ЁЁЁЁ)
A.ЖдгкCOЃЈgЃЉ+NO2ЃЈgЃЉ![]() CO2ЃЈgЃЉ+NOЃЈgЃЉЕФЦНКтЬхЯЕЃЌдіДѓбЙЧППЩЪЙбеЩЋБфЩю
CO2ЃЈgЃЉ+NOЃЈgЃЉЕФЦНКтЬхЯЕЃЌдіДѓбЙЧППЩЪЙбеЩЋБфЩю
B.ЧтЦјКЭЕЊЦјКЯГЩАБЕФЗДгІжаЃЌдкМгбЙЯТгаРћгкАБЕФЩњГЩ
C.ПЊЦєПЩРжЦПЃЌЦПжаТэЩЯЗКЦ№ДѓСПЦјХн
D.РћгУХХвКЗЈЪеМЏТШЦјЪБГЃгУвКЬхЮЊБЅКЭЪГбЮЫЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЯГІВн(Gelsemium)ЮЊжаЙњЙХДњОХДѓЖОвЉжЎвЛЃЌОнМЧдиФмЁАМћбЊЗтКэЁБЃЌЯжДњВщУїЫќЪЧКљТћЬйПЦжВЮяКљТћЬй,ЦфжаЕФЖОЫиКмЖрЃЌЯТСаЪЧЗжРыГіРДЕФЫФжжЖОЫиЕФНсЙЙМђЪНЃЌЯТСаЭЦЖЯе§ШЗЕФЪЧ( )

A.ЂкжаЫљКЌЙйФмЭХжжРрБШЂлжаЖр
B.ЂйЁЂЂмЛЅЮЊЭЌЯЕЮя
C.ЂйЁЂЂкЁЂЂлЁЂЂмОљФмЪЙфхЫЎЭЪЩЋ
D.ЕШЮяжЪЕФСПЂкЁЂЂлЗжБ№дкзуСПбѕЦјжаЭъШЋШМЩеЃЌЧАепЯћКФбѕЦјБШКѓепЩй
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЃЌПЩФцЗДгІA(Цј)ЃЋ3B(Цј)![]() 2CЃЈЦјЃЉДяЕНЦНКтЕФБъжОЪЧЃЈ ЃЉ
2CЃЈЦјЃЉДяЕНЦНКтЕФБъжОЪЧЃЈ ЃЉ
A. CЕФЩњГЩЫйТЪгыBЕФЩњГЩЫйТЪЯрЕШB. AЁЂBЁЂCЕФХЈЖШВЛдйЗЂЩњБфЛЏ
C. AЁЂBЁЂCЕФЗжзгЪ§жЎБШЮЊ1ЁУ3ЁУ2D. ЕЅЮЛЪБМфФкЯћКФnmolAЃЌЭЌЪБЯћКФ3nmolB
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com