
下列有关实验的说法正确的是
A. 用湿润的pH试纸测稀盐酸的pH
B. 用酸式滴定管量取20.00 mL酸性K2Cr2O7溶液
C. 用托盘天平称取5.85 gNaCl晶钵
D. 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
下列说法中不正确的是( )
A.1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L
B.1 mol臭氧和1.5 mol氧气含有相同的氧原子数
C.等体积、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
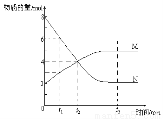
A.反应的化学方程式为: N == 2M
B.t2时,反应物和生成物的浓度相等,达到平衡
C.当M、N都是气体时增大压强,N物质的量减少
D.升高温度,平衡常数K增大,则反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验过程中pH变化如图所示,下列有关叙述正确的是
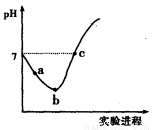
A.实验进程中可用pH试纸测定溶液的pH
B.a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
C.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D.由a点到b点的过程中,溶液中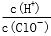 减小
减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
下列有关溶液中微粒的物质的量浓度关系正确的是
A.某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)
B.0.2 mol·L-1 CH3COONa溶液与0.1 mol·L-1盐酸等体积混合后的酸性溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C.室温下,向100mL 0.5mol/L的Na2CO3溶液中加入0.05molCaO,溶液中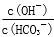 增大
增大
D.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)+c(Fe2+)=0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
 .
.| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol•L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |
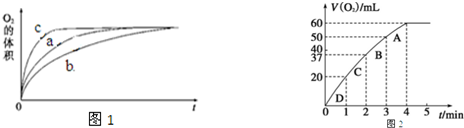
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
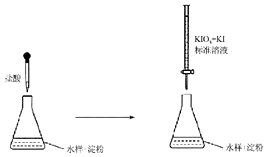 含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.
含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com