
| A. | 电极材料 Fe、Cu,电解质溶液 FeCl3 溶液 | |
| B. | 电极材料石墨、Cu,电解质溶液 Fe2(SO4)3溶液 | |
| C. | 电极材料 Pt、Cu,电解质溶液 FeCl3溶液 | |
| D. | 电极材料 Ag、Cu,电解质溶液 Fe2(SO4)3溶液 |
分析 电池总反应为 2Fe3++Cu═2Fe2++Cu2+,Cu失去电子,Fe得到电子,可知Cu为负极,正极为惰性电极或比Cu不活泼的金属,电解质溶液一定含铁离子,以此来解答.
解答 解:A.电极材料 Fe、Cu,电解质溶液 FeCl3 溶液,因Fe比Cu活泼,电池反应为2Fe3++Fe═3Fe2+,故A选;
B.电极材料石墨、Cu,电解质溶液 Fe2(SO4)3溶液,Cu作负极,电池总反应为 2Fe3++Cu═2Fe2++Cu2+,故B不选;
C.极材料 Pt、Cu,电解质溶液 FeCl3溶液,Cu作负极,电池总反应为 2Fe3++Cu═2Fe2++Cu2+,故C不选;
D.电极材料 Ag、Cu,电解质溶液 Fe2(SO4)3溶液,Cu作负极,电池总反应为 2Fe3++Cu═2Fe2++Cu2+,故D不选;
故选A.
点评 本题考查原电池的设计,为高频考点,把握电极判断、电池反应为解答的关键,侧重分析与应用能力的考查,注意Cu一定为负极且电解质为可溶性铁盐,题目难度不大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 乙醇催化氧化可制备乙醛 | B. | 乙醇与H2反应可制备乙烷 | ||
| C. | 乙醇与金属钠反应可制备乙醇钠 | D. | 乙醇与乙酸反应可制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| B | 向某溶液中滴加CCl4,振荡静置 | 下层溶液显紫色 | 原溶液中含有I- |
| C | 向25mL沸水中分别滴入5~6滴FeCl3饱和溶液,继续煮沸至出现红褐色沉淀,用激光笔照射 | 形成一条光亮通路 | 制得Fe(OH)3胶体 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常采用电解法冶炼Z单质 | |
| B. | 气态氢化物的稳定性:H2X>H2M | |
| C. | 离子半径由大到小:M2->Y+>Z3+>X2- | |
| D. | X、Y形成的化合物中阳离子、阴离子个数比一定是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应不属于化学变化 | |
| B. | 112 号元素的相对原子质量为 227 | |
| C. | 科学家合成的 112 号元素的原子的中子数为 165 | |
| D. | 112 号元素属于第七周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
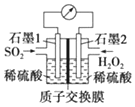 正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.
正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3 四甲基丁烷 | B. | 2,3,4 三甲基戊烷 | ||
| C. | 3,3,4,4 四甲基己烷 | D. | 2,5 二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-═2Fe2++S↓ | |
| C. | 向Fe(NO3) 2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
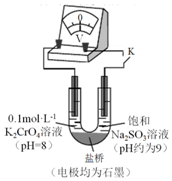 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:| 序号 | 操作 | 现象 |
| i | 向2mL pH=2的0.05mol•L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mL pH=8的0.1mol•L-1 K2CrO4黄色溶液中 滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
| 序号 | 操作 | 现象 |
| iii | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com