
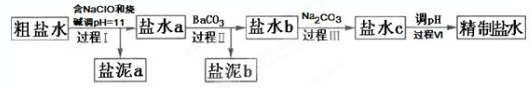
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
| A. | 盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2 | |
| B. | 过程Ⅰ中NH4+转化为N2的离子方程式是3ClO-+2NH4+═3Cl-+N2↑+3H2O+2H+ | |
| C. | 过程Ⅱ中通入CO2有利于除SO42- | |
| D. | 过程Ⅳ调pH可以使用硝酸 |
分析 含有Ca2+,Mg2+,NH4+,SO42-及泥沙的粗盐水,加入NaClO溶液可以氧化溶液中的NH4+,调节溶液pH=11,可使溶液里的Mg2+完全沉降,盐泥a的成分为泥沙和氢氧化镁,盐水a中加入BaCO3的目的是利用溶解平衡的移动,除去溶液里的Ca2+和SO42-,盐泥b为硫酸钡、CaCO3和过量的碳酸钡,盐水b中加入过量碳酸钠溶液可除去溶液里的钙离子,
步骤Ⅳ通过调节溶液的pH除去溶液里的CO32-,最终得到精制食盐水,据此分析作答;
A.根据杂质离子和溶液的酸碱性判断能反应生成的沉淀;
B.根据粗盐溶液成分和次氯酸根离子的氧化性质,结合氧化还原反应和质量守恒定律书写离子方程式;
C.根据溶液成分和溶解度大小判断生成的沉淀;
D.根据除杂时不能引入新的杂质来解答.
解答 解:含有Ca2+,Mg2+,NH4+,SO42-及泥沙的粗盐水,加入NaClO溶液可以氧化溶液中的NH4+,调节溶液pH=11,可使溶液里的Mg2+完全沉降,盐泥a的成分为泥沙和氢氧化镁,盐水a中加入BaCO3的目的是利用溶解平衡的移动,除去溶液里的SO42-,盐泥b为硫酸钡和过量的碳酸钡,盐水b中加入过量碳酸钠溶液可除去溶液里的钙离子,
步骤Ⅳ通过调节溶液的pH除去溶液里的CO32-,最终得到精制食盐水,据此分析作答;
A.操作Ⅰ调节溶液pH=11时,溶液里的Mg2+也转化为Mg(OH)2沉淀,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2,故A错误;
B.将NH4+转化为N2的氧化剂是NaClO,碱性条件下产物中应该是H2O,而不是H+,故B正确;
C.过程Ⅱ中通入CO2可促进BaCO3溶解,使溶液中Ba2+浓度增大,有利于除去溶液里的SO42-,故C正确;
D.过程Ⅳ调pH可以如果使用硝酸,溶液里引入NO3-将变成杂质无法除去,故D错误;
故选BC.
点评 本题考查粗盐的提纯,题目较为综合,注意平衡移动原理的应用以及物质的量应用于化学方程式的计算.做题时注意题中所给信息,用守恒的方法解答.


科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L NaOH溶液滴加醋酸 | |
| B. | 向氢硫酸饱和溶液中通入氯气 | |
| C. | 向氯化铜溶液中加入适量氢氧化钡溶液 | |
| D. | 向硝酸银溶液通入氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 13 | C. | 7 | D. | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素A: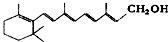 它是一种难溶于水的醇 它是一种难溶于水的醇 | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2 | |
| D. | 金属材料都是导体,非金属材料不都是绝缘体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
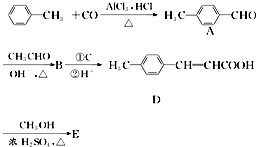
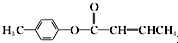 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为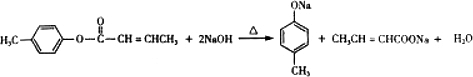 .
.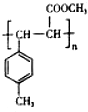 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、烧碱、氯酸钾、过氧化钠分别属于酸、碱、盐、碱性氧化物 | |
| B. | PM2.5指大气中直径接近于2.5×10-6 m的颗粒物,PM2.5在空气中形成胶体 | |
| C. | 氯气的水溶液能导电,因此氯气属于电解质 | |
| D. | 反应8NH3+3Cl2═N2+6NH4Cl中,氧化剂与还原剂物质的量之比是3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
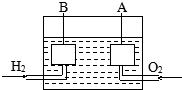 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com