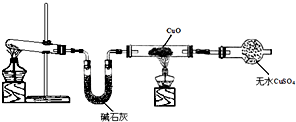
请回答:(1)实验室制取氨气的化学方程式为______.
(2)某同学用镊子夹取湿润的红色石蕊试纸靠近收集氨气的试管口,可观察到试纸变蓝,该现象说明氨气溶于水,溶液呈______性.
(3)干燥氨气可选用的试剂是______(填序号).
①碱石灰 ②浓硫酸
(4)围绕不活泼金属能否与硝酸反应,进行了如下实验探究:在两支试管中各放入一小块铜片,分别加入稀硝酸和浓硝酸,立即塞上带导管的胶塞,并将导管通入另一只盛有NaOH溶液的试管中.请回答:
①实验中观察到,其中一支试管中反应较缓慢,产生的一种气体是______(填化学式),产生该气体的化学方程式是______.
②另一支试管中反应剧烈,产生的一种红棕色气体是______(填化学式),产生该气体的化学方程式是______
(5)工业上由氨气合成硝酸这一过程涉及的化学方程式①______②______③______.
解:(1)实验室制取氨气是利用氢氧化钙和氯化铵固体加热反应生成;反应的化学方程式为:2NH
4Cl+Ca(OH)
2
2NH
3↑+2H
2O+CaCl
2,
故答案为:2NH
4Cl+Ca(OH)
2
2NH
3↑+2H
2O+CaCl
2(2)湿润的红色石蕊试纸靠近收集氨气的试管口,可观察到试纸变蓝,该现象说明氨气溶于水,氨气溶于水生成一水合氨,一水合氨电离出铵根离子和氢氧根离子,溶液呈碱性,
故答案为:碱性;
(3)氨气是碱性气体,用碱性干燥剂干燥,故答案为:①;
(4)依据稀硝酸和浓硝酸都和铜发生反应写出化学方程式;①实验中观察到,其中一支试管中反应较缓慢,产生的一种气体是一氧化氮,反应的化学方程式为:3Cu+8HNO
3=3Cu(NO
3)
2+2NO↑+4H
2O,故答案为:NO;3Cu+8HNO
3=3Cu(NO
3)
2+2NO↑+4H
2O;
②另一支试管中反应剧烈,产生的一种红棕色气体是二氧化氮,反应的化学方程式为:Cu+4HNO
3=Cu(NO
3)
2+2NO
2↑+2H
2O,
故答案为:NO
2;Cu+4HNO
3=Cu(NO
3)
2+2NO
2↑+2H
2O;
(5)依据工业制备硝酸的原理分析判断写出化学方程式;过程为氨气的催化氧化生成一氧化氮,一氧化氮氧化为二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮;反应的化学方程式为:4NH
3+5O
2
4NO+6H
2O,2NO+O
2=2NO
2,3NO
2+H
2O=2HNO
3+NO,故答案为:4NH
3+5O
2
4NO+6H
2O;2NO+O
2=2NO
2;3NO
2+H
2O=2HNO
3+NO.
分析:(1)实验室制取氨气是利用氢氧化钙和氯化铵固体加热反应生成;
(2)氨气溶于水生成一水合氨,一水合氨电离出铵根离子和氢氧根离子,溶液呈碱性;
(3)氨气是碱性气体,用碱性干燥剂干燥;
(4)依据稀硝酸和浓硝酸都和铜发生反应写出化学方程式;
(5)依据工业制备硝酸的原理分析判断写出化学方程式.
点评:本题考查了氮及其化合物性质的应用,主要考查氨气的实验室制备,氨气的检验,干燥,硝酸的强氧化性应用,化学方程式的书写方法,工业制备硝酸的化学方程式的书写应用,题目较简单.

 2NH3↑+2H2O+CaCl2,
2NH3↑+2H2O+CaCl2, 2NH3↑+2H2O+CaCl2
2NH3↑+2H2O+CaCl2 4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,故答案为:4NH3+5O2
4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,故答案为:4NH3+5O2 4NO+6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO.
4NO+6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

 海水中含有丰富的化学元素,如图是某化工厂利用海水的生产镁的流程简图,请回答:
海水中含有丰富的化学元素,如图是某化工厂利用海水的生产镁的流程简图,请回答: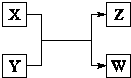 X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.
X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.