
【题目】下列各微粒的电子排布式或电子排布图不符合能量最低原理的是( )
A.![]() B.
B.![]()
C.F![]() D.Na+
D.Na+![]()
【答案】B
【解析】
能量最低原理:原子核外电子先占有能量较低的轨道,然后依次进入能量较高的轨道,电子填充顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、5f、6d、7p,结合泡利原理与洪特规则判断。
A.Fe2+离子核外电子数为24,由能量最低原理,可知核外电子排布为ls22s22p63s23p63d6,故A不选;
B.Cu原子核外电子数为29,满足半满全满的稳定结构,能量最低,核外电子排布应为ls22s22p63s23p63d104s1,故B选;
C.F原子最外电子层为第2电子层,有7个电子,外围电子排布为2s22p5,由泡利原理与洪特规则可知,外围电子轨道排布式为![]() ,故C不选;
,故C不选;
D.Na+离子最外电子层为第2电子层,有8个电子,外围电子排布为2s22p6,由泡利原理与洪特规则可知,外围电子轨道排布式为![]() ,故D不选;
,故D不选;
故答案选B。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成份是Al2O3,还含有Fe2O3、SiO2)提取氧化铝冶炼铝的原料(纯净的Al2O3),提取操作过程如下:

请回答下列问题:
(1)请写主要成份的化学式:滤渣A________,滤液丙中的溶质是NaCl和________。
(2)反应②中Al3+反应的离子方程式为_________________;反应③的离子方程式为____________;反应④的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在等温、等容条件下,有下列气体反应:2A(g)+2B(g)![]() C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2 mol/L和6 mol/L。下列叙述正确的是 ( )
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2 mol/L和6 mol/L。下列叙述正确的是 ( )
A.达到平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A)
B.达到平衡时,第Ⅰ条途径混合气体的密度与第Ⅱ条途径混合气体的密度相同
C.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同
D.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________;用杂化轨道理论解释:_________。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________。1 mol [Cd(NH3)4]2+含___________mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________。
(5)锆晶胞如图所示,1个晶胞含_______个Zr原子;这种堆积方式称为__________。

(6)镉晶胞如图所示。已知:NA是阿伏加德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
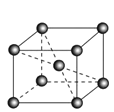
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种重要的有机化工合成中间体F和Y可用甲苯为主要原料采用以下路线制得:
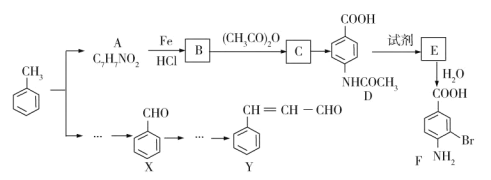
已知:
①![]()
![]()
![]()
②2CH3CHO![]() CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO![]() CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)写出A的结构简式___________。
(2)B→C的化学方程式是________。
(3)C→D的反应类型为__________。
(4)1molF最多可以和________molNaOH反应。
(5)在合成F的过程中,设计B→C步骤的目的是_________。
(6)写出符合下列条件的3种A的同分异构体的结构简式_________、______、_______。
①苯环上只有两种不同化学环境的氢原子
②能发生银镜反应
(7)以X和乙醇为原料通过3步可合成Y,请设计合成路线______(无机试剂及溶剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是( )
A | B | C | D | |
实验目的 | 制备氢氧化铁胶体 | 分离乙酸乙酯和饱和Na2CO3溶液 | 除去CO2中的少量HCl | 收集NO2 |
实验装置 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是( )
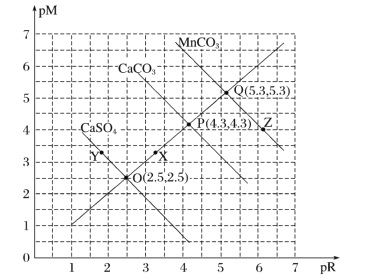
A.Y点:c(Ca2+)>c(SO42-),Z点:c(CO32-)>c(Mn2+)
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是某种低毒利尿药的主要成分。其合成路线如下(部分条件已略):
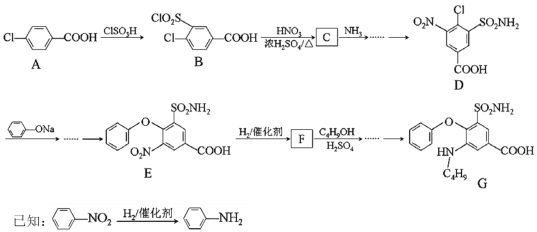
回答下列问题:
(1)A的化学名称______,A中的官能团_______。
(2)A→B的反应类型______,E→F的反应类型_______。
(3)D的分子式_____,F的结构简式_______。
(4)B→C的化学反应方程式________。
(5)若G发生自身缩聚反应,其缩聚产物的链节结构为________(写一种)。
(6)C4H9OH的同分异构体中属于醇的有___种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为___。
(7)以甲苯(其他无机试剂任选)为原料合成 的合成路线为_______。
的合成路线为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
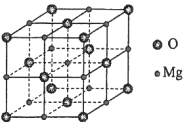
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com