
| A. | 1-甲基戊烷 | B. | 2-乙基戊烷 | ||
| C. | 2,5-二甲基己烷 | D. | 2,4,4-三甲基戊烷 |
分析 烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析.
解答 解:A、烷烃命名时,要选最长的碳链为主链,故此有机物主链上有6个碳原子,故为己烷,故A错误;
B、烷烃命名时,要选最长的碳链为主链,故主链上有6个碳原子,从离支链近的一端给主链上碳原子编号,故在3号碳原子上有一个甲基,故名称为3-甲基己烷,故B错误;
C、烷烃命名时,要选最长的碳链为主链,故主链上有6个碳原子,为己烷,从离支链近的一端给主链上碳原子编号,故在2号和5号碳原子上各有一个甲基,故为2,5-二甲基己烷,故C正确;
D、烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,为戊烷,从离支链近的一端给主链上碳原子编号,当两端离支链一样近时,从支链多的一端开始编号,故在2号碳原子上有2个甲基,在4号碳原子上有一个甲基,故名称为2,2,4-三甲基戊烷,故D错误.
故选C.
点评 本题考查了烷烃的命名,难度不大,应注意的是烷烃命名时,当两端离支链一样近时,从支链多的一端开始编号.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能存在非极性键 | |
| B. | 硫酸分子中有H+和SO42-两种离子 | |
| C. | 某原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键 | |
| D. | 离子键和共价键的实质都是电性的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:X<Y<Z | |
| B. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| C. | 原子半径:按X、Y、Z变小 | |
| D. | 气态氢化物稳定性:按X、Y、Z顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
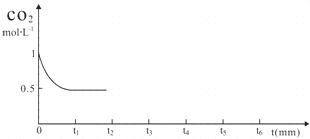
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
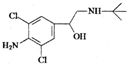
| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质易溶于盐酸 | |
| C. | 该物质的1H核磁共振谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论或实验目的 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 溶液中有Na+,无K+ |
| B | 向硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 非金属性:Cl>Si |
| C | 向Ba(NO3)2溶液中通入SO2,有白色沉淀产生 | SO2具有还原性 |
| D | 将含少量KNO3杂质的NaCl晶体制成热的饱和溶液,冷却结晶,过滤 | 除去NaCl中的KNO3杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com