
【题目】某元素原子的最外层电子数是次外层电子数的3倍,且最外层电子数与次外层电子数之和小于10。该元素为( )
A. 锂B. 铍C. 钙D. 氧
科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO (慢):②FeO++CO=CO2+Fe+ (快)。下列说法正确的是

A. 反应①是氧化还原反应,反应②是非氧化还原反应
B. 两步反应均为放热反应,总反应的化学反应速率由反应②决定
C. Fe+使反应的活化能减小,FeO+是中间产物
D. 若转移lmol电子,则消耗II.2LN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系不正确的是
A. pH相等的 NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa)
B. 0.1mol·L-1的NaOH溶液与0.2mol·L-1的HA溶液等体积混合,所得溶液呈碱性:c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+)
C. 25℃时,0.1 mol·L-1 Na2CO3溶液中水电离出来的c(OH-)大于0.1 mol·L-1 NaOH溶液中水电离出来的c(OH-)
D. 已知25℃时Ksp(AgCl)=1.8×10-10,则在该温度下0.3 mol·L -1NaCl溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________。
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)

①SOCl2在该实验中的作用_________________________________;加热条件下,A装置中总的化学方程式为_________________________________。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________(保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若无明显现象 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2 △H1=akJ/mol
3Fe2O3(s)+ CO(g)====2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=___________kJ/mol(用含a、b的代数式表示)
Ⅱ.光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:

(1)①T℃时,在容器中若充入稀有气体,平衡___________移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡___________移动。
②CO体积分数为80%时,CO2的转化率为___________。
③已知:气体分压(p分)=气体总压×体积分数。T℃时用平衡分压代替平衡浓度表示平衡常数Kp=___________(用含p总的代数式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:

则△H___________0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器内,充入一定量的NO和O2,800°C时发生反应2NO(g)+O2(g)![]() 2NO2(g),容器中n(NO)随时间的变化如表所示:
2NO2(g),容器中n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应在1~2s内,O2的物质的量减少__mol。该反应在第3s___(填“达到”或“未达到”)平衡状态。
(2)如图所示,表示NO2浓度变化曲线的是___(填字母)。用O2表示0~2s内该反应的平均速率v=___mol·L-1·s-1。
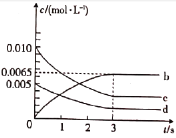
(3)能说明该反应已达到平衡状态的是___(填字母)。
a.容器内气体颜色不再变化
b.O2的物质的量保持不变
c.容器内混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2![]() 2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是

A. b极为电池的负极
B. 电池放电时Li+移向a极
C. b极的电极方程式为N2+6Li++6e- = 2Li3N
D. 金属锂在放电过程中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室进行物质制备时,下列从原料及有关试剂分解制取相应的最终产物的设计中,理论上有错误或操作上不可行或经济上不合理的是( )
A. FeFe2O3 ![]() Fe2(SO4)3溶液
Fe2(SO4)3溶液
B. C![]() CO
CO![]() CO2
CO2![]() Na2CO3溶液
Na2CO3溶液
C. CuO![]() CuSO4溶液
CuSO4溶液![]() Cu
Cu
D. CaO![]() Ca(OH)2溶液
Ca(OH)2溶液![]() NaOH溶液
NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com