
ÓŠ¢ŁNa2CO3ČÜŅŗ ¢ŚCH3COONaČÜŅŗ ¢ŪNaOHČÜŅŗø÷25 mL£¬ĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1 mol·L-1£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ( )
A£®3ÖÖČÜŅŗpHµÄ“óŠ”Ė³ŠņŹĒ¢Ū>¢Ś>¢Ł
B£®Čō½«3ÖÖČÜŅŗĻ”ŹĶĻąĶ¬±¶Źż£¬pH±ä»Æ×ī“óµÄŹĒ¢Ś
C£®Čō·Ö±š¼ÓČė25 mL 0.1 mol·L£1µÄŃĪĖįŗó£¬pH×ī“óµÄŹĒ¢Ł
D£®Čō3ÖÖČÜŅŗµÄpH¾łĪŖ9£¬ŌņĪļÖŹµÄĮæÅØ¶ČµÄ“óŠ”Ė³ŠņŹĒ¢Ū>¢Ł>¢Ś
 Š”ѧ¶į¹ŚAB¾ķĻµĮŠ“š°ø
Š”ѧ¶į¹ŚAB¾ķĻµĮŠ“š°ø ABCæ¼ĶõČ«ÓžķĻµĮŠ“š°ø
ABCæ¼ĶõČ«ÓžķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĄė×Ó×éÖŠĖłøųĄė×ÓŌŚĖ®ČÜŅŗÖŠÄÜ“óĮæ¹²“ę£¬ĒŅµ±¼ÓČėŹŌ¼Įŗó·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹéŠ“ĶźČ«ĒŅÕżČ·µÄŹĒ (””””)
| Ń”Ļī | Ąė×Ó×é | ¼ÓČėŹŌ¼Į | ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ |
| A | Fe3+”¢S2”„”¢Cl”„”¢Na+ | NaOHČÜŅŗ | Fe3£«+3OH”„=Fe(OH)3”ż |
| B | Na+”¢Al3+”¢Cl”„”¢SO42”„ | ÉŁĮæKOHČÜŅŗ | Al3++3OH”„=Al(OH)3”ż |
| C | H+”¢Fe2£«”¢SO42”„”¢NO3”„ | BaCl 2ČÜŅŗ | SO42”„+Ba2£«=BaSO4”ż |
| D | Na+”¢K+”¢ClO”„”¢ SO42”„ | ĶØČėÉŁĮæSO2 | 2ClO”„+SO2+H2O=2HClO+SO32”„ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ
A£®µČĪļÖŹµÄĮæµÄNH4HCO3ÓėBa(OH)2ČÜŅŗ»ģŗĻŗó¼ÓČČ£ŗNH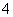 £«OH£
£«OH£NH3”ü£«H2O
B£®ĖįŠŌµÄµķ·Ūµā»Æ¼ŲČÜŅŗŌŚæÕĘųÖŠ±äĄ¶£ŗ4I££«O2 £«4H+= 2H2O £«2I2
C£®1molCl2ĶØČėŗ¬1mol FeI2µÄČÜŅŗÖŠ£ŗ2Fe2£«£«2I££«2Cl2£½2Fe3£«£«4Cl££«I2
D£®¹żĮæSO2ĶØČėBa(NO3)2ČÜŅŗÖŠ£ŗ3SO2+2NO3-+3Ba2++2H2O£½3BaSO4”ż+2NO”ü+4H+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ (””””)
A£®Ź³ŃĪČÜŅŗÖŠ³żČ„SO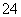 ×īŗĻŹŹµÄŹŌ¼ĮŹĒBa(NO3)2
×īŗĻŹŹµÄŹŌ¼ĮŹĒBa(NO3)2
B£®NaClČÜŅŗŗĶCH3COONH4ČÜŅŗ¾łĻŌÖŠŠŌ£¬Į½ČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶ČĻąĶ¬
C£®25 ”ꏱ,ÓĆ“×ĖįČÜŅŗÖŠŗĶµČÅضČNaOHČÜŅŗÖĮpH£½7£¬VCH3COOH£¼VNaOH
D£®AgClŅ××Ŗ»ÆĪŖAgI³ĮµķĒŅKsp(AgX)£½[Ag£«]·[X£]£¬¹ŹKsp(AgI)£¼Ksp(AgCl)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
³£ĪĀĻĀ£¬ĻĀĮŠĄė×ÓÅØ¶ČµÄ¹ŲĻµÕżČ·µÄŹĒ (””””)
A£®pH£½2µÄŃĪĖįÓėpH£½12µÄ°±Ė®µČĢå»ż»ģŗĻ£ŗ
c(NH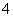 )£½c(Cl£)£¾c(H£«)£½c(OH£)
)£½c(Cl£)£¾c(H£«)£½c(OH£)
B£®0.2 mol·L£1µÄCH3COONaČÜŅŗÓė0.1 mol·L£1µÄHClµČĢå»ż»ģŗĻ£ŗ
c(Na£«)£¾c(Cl£)£¾c(CH3COO£)£¾c(H£«)£¾c(OH£)
C£®0.1 mol·L£1µÄHCN(ČõĖį)ŗĶ0.1 mol·L£1µÄNaCNµČĢå»ż»ģŗĻ£ŗ
c(HCN)£«c(CN£)£«c(OH£)£½c(Na£«)£«c(H£«)
D£®ĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČŹ±£¬ČÜŅŗÖŠc(NH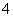 )Óɓ󵽊”µÄĖ³Šņ£ŗNH4Al(SO4)2£¾NH4Cl£¾CH3COONH4£¾NH3·H2O
)Óɓ󵽊”µÄĖ³Šņ£ŗNH4Al(SO4)2£¾NH4Cl£¾CH3COONH4£¾NH3·H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖijČÜŅŗÖŠÖ»“ęŌŚOH£”¢H+”¢NH4+”¢Cl£ĖÄÖÖĄė×Ó£¬Ä³Ķ¬Ń§ĶĘ²āøĆČÜŅŗÖŠø÷Ąė×ÓÅØ¶Č“óŠ”Ė³ŠņæÉÄÜÓŠČēĻĀĖÄÖÖ¹ŲĻµ£ŗ
A£®c(Cl£)£¾c(NH4+)£¾c(H+)£¾c(OH£)
B£®c(Cl£)£¾c(NH4+)£¾c(OH£)£¾c(H+)
C£®c(Cl£)£¾c(H+)£¾c(NH4+)£¾c(OH£)
D£®c(NH4+)£¾c(Cl£)£¾c(OH£)£¾c(H+)
£Ø1£©ČōČÜŅŗÖŠÖ»ČܽāĮĖŅ»ÖÖČÜÖŹ£¬øĆČÜÖŹŹĒ £¬ÉĻŹöĄė×ÓÅØ¶Č“óŠ”Ė³Šņ¹ŲĻµÖŠÕżČ·µÄŹĒ£ØŃ”ĢīŠņŗÅ£© ”£
£Ø2£©ČōÉĻŹö¹ŲĻµÖŠDŹĒÕżČ·µÄ£¬»ģŗĻŗóČÜŅŗÖŠµÄČÜÖŹĪŖ ”£
£Ø3£©25 ”ꏱ£¬½«a mol·L£1µÄ°±Ė®Óėb mol·L£1ŃĪĖįµČĢå»ż»ģŗĻ£¬·“Ó¦ŗóČÜŅŗĒ”ŗĆĻŌÖŠŠŌ£¬Ōņ»ģŗĻĒ°a b£ØĢī”°>”±”¢”°<”±”¢»ņ”°=”±£©, ÓĆa”¢b±ķŹ¾NH3·H2OµÄµēĄėĘ½ŗā³£ŹżĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŌĻĀ·“Ó¦æÉŅŌÓĆģŲÅŠ¾ŻĄ“½āŹĶµÄŹĒ
A£®ĮņĖįĶ±„ŗĶČÜŅŗ½µµĶĪĀ¶ČŹ±ÓŠ¾§ĢåĪö³ö
B£®(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) ”÷H=+74.9kJ/mol
C£®CaO(s)+CO2(g)==CaCO3(s) ”÷H=-175.7kJ/mol
D£®2H2(g)+O2(g) ==2H2O(l) ”÷H=-285.8kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖNH3”¤H2O£Øaq£©ÓėH2SO4£Øaq£©·“Ӧɜ³É1molÕżŃĪµÄ·“Ó¦ČČ
”÷H= -24.2kJ/moL£»Ļ”ŃĪĖįÓėĻ”ĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄÖŠŗĶČČ”÷H= -57£®3kJ/mol”£
ŌņNH3•H2OŌŚĖ®ČÜŅŗÖŠµēĄėµÄ”÷HµČÓŚ
A£®-69.4kJ/mol B£®-45.2 kJ/mol C£®+69.4kJ/mol D£®+45.2 kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«4 g NaOH¹ĢĢåČÜÓŚĖ®Åä³É250 mLČÜŅŗ£¬“ĖČÜŅŗÖŠNaOHµÄĪļÖŹµÄĮæÅضČĪŖ__________”£Č”³ö10 mL“ĖČÜŅŗ£¬Õā10 mLČÜŅŗÖŠNaOHµÄĪļÖŹµÄĮæÅضČĪŖ___________£¬ĘäÖŠŗ¬ÓŠNaOH________g”£½«Č”³öµÄČÜŅŗ¼ÓĖ®Ļ”ŹĶµ½100 mL£¬Ļ”ŹĶŗóµÄČÜŅŗÖŠNaOHµÄĪļÖŹµÄĮæÅضČĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com