
【题目】Ⅰ.某化学兴趣小组用以下装置探究SO2的某些化学性质。
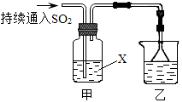
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);
若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 ;
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
![]() Ca2++
Ca2++![]() ClO-+
ClO-+![]() SO2+
SO2+![]() H2O=
H2O=![]() CaSO4↓+
CaSO4↓+![]() Cl-+
Cl-+![]() SO42-+
SO42-+![]() 。
。
Ⅱ.某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验。
i.取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液。
(4)搅拌的目的是 。
(5)取少量滤液于试管中,向其中滴加几滴0.1 mol·L-1KI溶液,观察到的现象是 。
ii.准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH + Pb2+= R2Pb + 2H+,交换完成后,流出溶液用滴定法测得n(H+)=3.000×10-5 mol。
(6)在此实验温度下,PbI2的溶度积常数Ksp= 。若步骤i盛装滤液的烧杯中有少量水,Ksp测定结果将会 (填“偏大”、“偏小”或“无影响”)。
【答案】(1)吸收多余的SO2(尾气处理也给分)(2)c(1分)a(1分)
(3)1,2,2,2,1,2,1,4H+(Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+ SO42-+4H+ )
(4)使碘化铅充分溶解(或加速溶解)
(5)产生黄色沉淀(或黄色浑浊)(2分)
(6)1.350×10-8[写1.35×10-8或1.35×10-8(mol·L-1)3均得2分](2分); 偏小(2分)
【解析】
试题分析:(1)SO2有毒,所以装置乙的作用是吸收多余的SO2。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有漂白性;若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,即有单质S生成,这说明SO2具有氧化性;
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,这说明SO2被氧化为硫酸根,反应中S元素化合价从+4价升高到+6价,失去2个电子。氯元素化合价从+1价降低到-1价,得到2个电子,所以根据电子得失守恒和原子守恒可知该过程的离子方程式为Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+ SO42-+4H+。
(4)固体溶解时要用玻璃杯搅拌加速溶解,所以搅拌的目的是使碘化铅充分溶解;
(5)碘化铅饱和溶液中存在沉淀溶解平衡,向滤液中滴加几滴0.1molL-1 KI溶液,则碘离子浓度增大,沉淀溶解平衡逆移,溶液中c(Pb2+)减小,溶液中会析出沉淀,所以观察到的现象为:产生黄色沉淀或黄色浑浊;
(6)准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH+Pb2+=R2Pb+2H+,交换完成后,流出溶液用中和滴定法测得n(H+)=3.000×10-5mol,则n(Pb2+)=1.500×10-5mol,所以c(Pb2+)=1.5000×105mol/0.01L=1.500×10-3mol/L,所以c(I-)=2c(Pb2+)=3.000×10-3mol/L,所以Ksp(PbI2)=c(Pb2+)×c2(I-)=1.35×10-8;若步骤Ⅰ盛装滤液的烧杯中有少量水,则滤液的浓度减小,量取10.00mL滤液,则滤液中碘离子和铅离子的物质的量偏小,所以求出的Ksp偏小.


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
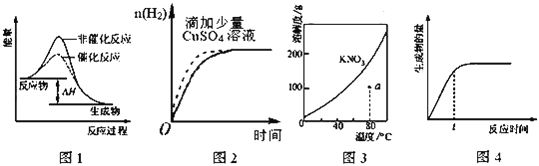
A. 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C. 图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D. 图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1 mol/L。下面四个选项中能达到此目的的是( )
A. Na+、K+、SO42-、Cl- B. K+、Cu2+、SO42-、NO3-
C. K+、H+、Cl-、HCO3- D. Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 氢气的摩尔质量是2g B. 摩尔是物质的质量单位
C. 1 mol OH—的质量是17g D. 1mol气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列说法中正确的是
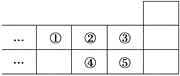
A. 元素①位于第2周期第ⅣA族
B. 气态氢化物的稳定性:④>②
C. 最高价氧化物对应水化物的酸性:⑤>④
D. 元素的最高正化合价:③=⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化。一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。下列判断正确的是
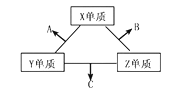
A. 原子半径 :Z<Y<X B. 非金属性 Z>Y>X
C. 化合物A易溶于水 D. 化合物B与C的混合物呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com