

 £®
£®

 ĘĖČČĻ¢Ķ“µÄ½į¹¹¼ņŹ½ĪŖ
ĘĖČČĻ¢Ķ“µÄ½į¹¹¼ņŹ½ĪŖ


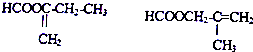
·ÖĪö BŗĶHCN·“Ӧɜ³ÉCH3C£ØOH£©CNCH3£¬ŌņBµÄ½į¹¹¼ņŹ½ĪŖCH3COCH3£¬A·¢ÉśŃõ»Æ·“Ӧɜ³É±ūĶŖŗĶ±½·Ó£¬ŌņAµÄ½į¹¹¼ņŹ½ĪŖ £¬DĪļÖŹĘäÖŹĘ×Ķ¼ĻŌŹ¾Ļą¶Ō·Ö×ÓÖŹĮæĪŖ100£¬10gDµÄĪļÖŹµÄĮæ=$\frac{10g}{100g/mol}$=0.1mol£¬Éś³É¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæ=$\frac{22.0g}{44g/mol}$=0.5mol£¬Éś³ÉĖ®µÄĪļÖŹµÄĮæ=$\frac{7.2g}{18g/mol}$=0.4mol£¬
£¬DĪļÖŹĘäÖŹĘ×Ķ¼ĻŌŹ¾Ļą¶Ō·Ö×ÓÖŹĮæĪŖ100£¬10gDµÄĪļÖŹµÄĮæ=$\frac{10g}{100g/mol}$=0.1mol£¬Éś³É¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæ=$\frac{22.0g}{44g/mol}$=0.5mol£¬Éś³ÉĖ®µÄĪļÖŹµÄĮæ=$\frac{7.2g}{18g/mol}$=0.4mol£¬
ŌņD·Ö×ÓÖŠŗ¬ÓŠ5øöCŌ×Ó”¢8øöHŌ×Ó£¬DµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ100£¬ŌņDÖŠ»¹ŗ¬ÓŠOŌ×Ó£¬OŌ×ÓøöŹż=$\frac{100-12”Į5-1”Į8}{16}$=2£¬ĖłŅŌDµÄ·Ö×ÓŹ½ĪŖC5H8O2£¬Ęä²»±„ŗĶ¶Č=$\frac{5”Į2+2-8}{2}$=3£¬DÄÜ·¢Éś¼Ó¾Ū·“Ó¦ĖµĆ÷ŗ¬ÓŠĢ¼Ģ¼Ė«¼ü»ņČż¼ü£¬ĖįŠŌĢõ¼žĻĀCH3C£ØOH£©CNCH3ŗĶ¼×“¼·¢Éśõ„»Æ·“Ó¦£¬Ķ¬Ź±×ŌÉķ·¢ÉśĻūČ„·“Ó¦£¬ŌņDµÄ½į¹¹¼ņŹ½ĪŖCH2=C£ØCH3£©COOCH3£¬D·¢Éś¼Ó¾Ū·“Ӧɜ³ÉE£¬ŌņEµÄ½į¹¹¼ņŹ½ĪŖ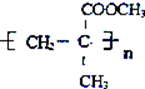 £¬
£¬
øł¾ŻĢāøųŠÅĻ¢ÖŖ£¬CH2=C£ØCH3£©COOHŗĶSOCl·“Ӧɜ³ÉG£¬GµÄ½į¹¹¼ņŹ½ĪŖCH2=C£ØCH3£©COCl£¬H·¢Éś¼Ó¾Ū·“Ӧɜ³Éŗ¬ĘĖČČĻ¢Ķ“øß·Ö×ÓŅ©Īļ£¬ŌņHµÄ½į¹¹¼ņŹ½ĪŖ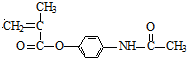 £¬GŗĶĘĖČČĻ¢Ķ“·“Ӧɜ³ÉH£¬ŌņĘĖČČĻ¢Ķ“½į¹¹¼ņŹ½ĪŖ
£¬GŗĶĘĖČČĻ¢Ķ“·“Ӧɜ³ÉH£¬ŌņĘĖČČĻ¢Ķ“½į¹¹¼ņŹ½ĪŖ £¬ŌŁ½įŗĻĢāÄæ·ÖĪö½ā“š£®
£¬ŌŁ½įŗĻĢāÄæ·ÖĪö½ā“š£®
½ā“š ½ā£ŗBŗĶHCN·“Ӧɜ³ÉCH3C£ØOH£©CNCH3£¬ŌņBµÄ½į¹¹¼ņŹ½ĪŖCH3COCH3£¬A·¢ÉśŃõ»Æ·“Ӧɜ³É±ūĶŖŗĶ±½·Ó£¬ŌņAµÄ½į¹¹¼ņŹ½ĪŖ £¬DĪļÖŹĘäÖŹĘ×Ķ¼ĻŌŹ¾Ļą¶Ō·Ö×ÓÖŹĮæĪŖ100£¬10gDµÄĪļÖŹµÄĮæ=$\frac{10g}{100g/mol}$=0.1mol£¬Éś³É¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæ=$\frac{22.0g}{44g/mol}$=0.5mol£¬Éś³ÉĖ®µÄĪļÖŹµÄĮæ=$\frac{7.2g}{18g/mol}$=0.4mol£¬
£¬DĪļÖŹĘäÖŹĘ×Ķ¼ĻŌŹ¾Ļą¶Ō·Ö×ÓÖŹĮæĪŖ100£¬10gDµÄĪļÖŹµÄĮæ=$\frac{10g}{100g/mol}$=0.1mol£¬Éś³É¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæ=$\frac{22.0g}{44g/mol}$=0.5mol£¬Éś³ÉĖ®µÄĪļÖŹµÄĮæ=$\frac{7.2g}{18g/mol}$=0.4mol£¬
ŌņD·Ö×ÓÖŠŗ¬ÓŠ5øöCŌ×Ó”¢8øöHŌ×Ó£¬DµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ100£¬ŌņDÖŠ»¹ŗ¬ÓŠOŌ×Ó£¬OŌ×ÓøöŹż=$\frac{100-12”Į5-1”Į8}{16}$=2£¬ĖłŅŌDµÄ·Ö×ÓŹ½ĪŖC5H8O2£¬Ęä²»±„ŗĶ¶Č=$\frac{5”Į2+2-8}{2}$=3£¬DÄÜ·¢Éś¼Ó¾Ū·“Ó¦ĖµĆ÷ŗ¬ÓŠĢ¼Ģ¼Ė«¼ü»ņČż¼ü£¬ĖįŠŌĢõ¼žĻĀCH3C£ØOH£©CNCH3ŗĶ¼×“¼·¢Éśõ„»Æ·“Ó¦£¬Ķ¬Ź±×ŌÉķ·¢ÉśĻūČ„·“Ó¦£¬ŌņDµÄ½į¹¹¼ņŹ½ĪŖCH2=C£ØCH3£©COOCH3£¬D·¢Éś¼Ó¾Ū·“Ӧɜ³ÉE£¬ŌņEµÄ½į¹¹¼ņŹ½ĪŖ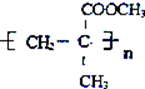 £¬
£¬
øł¾ŻĢāøųŠÅĻ¢ÖŖ£¬CH2=C£ØCH3£©COOHŗĶSOCl·“Ӧɜ³ÉG£¬GµÄ½į¹¹¼ņŹ½ĪŖCH2=C£ØCH3£©COCl£¬H·¢Éś¼Ó¾Ū·“Ӧɜ³Éŗ¬ĘĖČČĻ¢Ķ“øß·Ö×ÓŅ©Īļ£¬ŌņHµÄ½į¹¹¼ņŹ½ĪŖ £¬GŗĶĘĖČČĻ¢Ķ“·“Ӧɜ³ÉH£¬ŌņĘĖČČĻ¢Ķ“½į¹¹¼ņŹ½ĪŖ
£¬GŗĶĘĖČČĻ¢Ķ“·“Ӧɜ³ÉH£¬ŌņĘĖČČĻ¢Ķ“½į¹¹¼ņŹ½ĪŖ £¬
£¬
£Ø1£©ĶعżŅŌÉĻ·ÖĪöÖŖ£¬AµÄ½į¹¹¼ņŹ½ĪŖ £¬ĘĖČČĻ¢Ķ“½į¹¹¼ņŹ½ĪŖ
£¬ĘĖČČĻ¢Ķ“½į¹¹¼ņŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£» £»
£»
£Ø2£©ĶعżŅŌÉĻ·ÖĪöÖŖ£¬øĆ·“Ó¦ĪŖ¼Ó³É·“Ó¦£¬¹Ź“š°øĪŖ£ŗ¼Ó³É£»
£Ø3£©C6H6OĪŖ±½·Ó£¬ÄÜɱ¾śĻū¶¾£¬¹Ź“š°øĪŖ£ŗɱ¾śĻū¶¾£»
£Ø4£©ĶعżŅŌÉĻ·ÖĪöÖŖ£¬DµÄ½į¹¹¼ņŹ½ĪŖCH2=C£ØCH3£©COOCH3£¬DÖŠ¹ŁÄÜĶÅĪŖĢ¼Ģ¼Ė«¼üŗĶõ„»ł£¬D·¢Éś¼Ó³É·“Ӧɜ³ÉE£¬·“Ó¦·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗĢ¼Ģ¼Ė«¼üŗĶõ„»ł£» £»
£»
£Ø5£©ŗ¬ĘĖČČĻ¢Ķ“øß·Ö×ÓŅ©ĪļÓė×ćĮæĒāŃõ»ÆÄĘČÜŅŗ·¢ÉśČ”“ś·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø6£©DµÄ½į¹¹¼ņŹ½ĪŖCH2=C£ØCH3£©COOCH3£¬DµÄĶ¬·ÖŅģ¹¹Ģå·ūŗĻĻĀĮŠĢõ¼ž£¬¢ŁÓėD¾ßÓŠĻąĶ¬¹ŁÄÜĶÅĖµĆ÷ŗ¬ÓŠõ„»łŗĶĢ¼Ģ¼Ė«¼ü£¬¢ŚÄÜ·¢ÉśŃŪ¾µ·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠ¼×õ„»ł£¬¢ŪHŗĖ“Ź²ÕńĘ×ÖŠÓŠĖÄÖÖ²»Ķ¬»·¾³µÄĒāŌ×ӱȥż·Ö±šĪŖ1£ŗ2£ŗ2£ŗ3£¬ĖµĆ÷øĆ·Ö×ÓÖŠŗ¬ÓŠ4ÖÖĄąŠĶµÄHŌ×Ó£¬·ūŗĻĢõ¼žµÄDµÄĶ¬·ÖŅģ¹¹ĢåÓŠ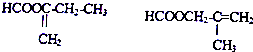 £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ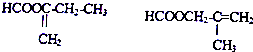 £®
£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļĶʶĻ£¬²ąÖŲæ¼²éѧɜ·ÖĪöÄÜĮ¦”¢ĶʶĻÄÜĮ¦£¬ŅŌCH3C£ØOH£©CNCH3ĪŖĶ»ĘĘæŚ²ÉÓĆÕżÄę½įŗĻµÄ·½·ØĶʵ¼£¬ÖŖµĄ³£¼ūÓŠ»śĪļµÄ¹ŁÄÜĶż°Äܹ»·¢ÉśµÄ·“Ó¦£¬×¢Ņā½įŗĻĢāøųŠÅĻ¢·ÖĪö½ā“š£¬ÄѵćŹĒĶ¬·ÖŅģ¹¹ĢåÖÖĄąµÄÅŠ¶Ļ£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 36gĆ¾ŌŚ×ćĮæµÄµŖĘųÖŠĶźČ«Č¼ÉÕ¹²×ŖŅʵĵē×ÓŹżĪŖ3NA | |
| B£® | ŹŅĪĀĻĀ£¬21.0gŅŅĻ©ŗĶ¶”Ļ©µÄ»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄC-H¹²¼Ū¼üŹżÄæĪŖ3NA | |
| C£® | ±ź×¼×“æöĻĀ£¬44.8 L NOÓė22.4 LO2»ģŗĻŗóĘųĢåÖŠ·Ö×Ó×ÜŹżĪŖ3NA | |
| D£® | 1 molNa2OŗĶNa2O2»ģŗĻĪļÖŠŗ¬ÓŠµÄŅõ”¢ŃōĄė×Ó×ÜŹżŹĒ3NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | Ņ»¶Ø²»“ęŌŚBa2+£¬NH4+æÉÄÜ“ęŌŚ | B£® | CO32-Ņ»¶Ø“ęŌŚ | ||
| C£® | Na+Ņ»¶Ø“ęŌŚ | D£® | Ņ»¶Ø²»“ęŌŚCl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »ÆŗĻ·“Ó¦ | B£® | ÖĆ»»·“Ó¦ | C£® | Ńõ»Æ»¹Ō·“Ó¦ | D£® | ø“·Ö½ā·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ćū³Ę | ·Ö×ÓĮæ | ŠŌד | Ļą¶ŌĆÜ¶Č £Øg•cm-3£© | ·Šµć £Ø”ę£© | Čܽā¶Č | ||
| Ė® | ŅŅĆŃ | ||||||
| ±½¼×Č© | 106 | ĪŽÉ«ŅŗĢå | 1.04 | 179 | Ī¢ČÜ | Ņ×ČÜ | |
| ±½¼×Ėį | 122 | ĪŽÉ«¾§Ģå | 1.27 | 249 | 0.21g | 66g | |
| ±½¼×“¼ | 108 | ĪŽÉ«ŅŗĢå | 1.04 | 205 | Ī¢ČÜ | Ņ×ČÜ | |
| ŅŅĆŃ | 74 | ĪŽÉ«ŅŗĢ壮 | 0.71 | 35 | ²»ČÜ | -- | |
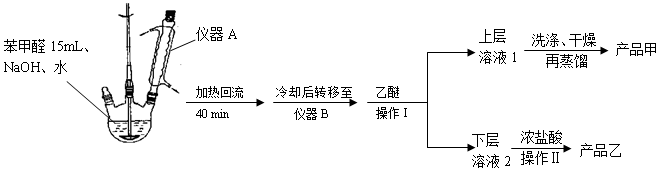
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
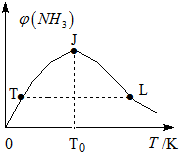 ĒāĘųŹĒŠĀŠĶÄÜŌ“ŗĶÖŲŅŖ»Æ¹¤ŌĮĻ£®
ĒāĘųŹĒŠĀŠĶÄÜŌ“ŗĶÖŲŅŖ»Æ¹¤ŌĮĻ£®| ČŻĘ÷±ąŗÅ | ĘšŹ¼Ź±ø÷ĪļÖŹµÄĪļÖŹµÄĮæ/mol | Ę½ŗāŹ±·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ | ||
| H2 | N2 | NH3 | ||
| ¢ń | 3n | n | 0 | ·Å³öČČĮæa kJ |
| ¢ņ | 3n | 2n | 0 | ·Å³öČČĮæb kJ |
| ¢ó | 6n | 2n | 0 | ·Å³öČČĮæc kJ |
| Ź±¼ä/min | 0 | 5 | 10 | 15 | 20 | 25 | ” |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
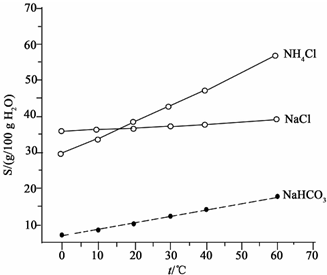
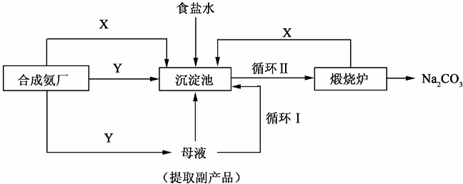
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | x=0.6a 2Fe2++Cl2=2Fe3++2Cl- | |
| B£® | x=a 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| C£® | x=0.4a 2Br-+Cl2=Br2+2Cl- | |
| D£® | x=2a 2Fe2++6Br-+4Cl2=3Br2+2Fe3++8Cl- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com