
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A. 1:9 B. 1:7 C. 1:5 D. 2:9
考点: 氧化还原反应的计算.
专题: 守恒法.
分析: Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由﹣2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.令NO2和NO的物质的量分别为1mol、1mol,根据电子转移守恒计算参加反应的Cu2S的物质的量,由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO),根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)﹣n(CuSO4),由硫元素守恒可知n(Cu2S)=n(CuSO4),据此计算参加反应的硝酸的物质的量.据此计算判断.
解答: 解:Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由﹣2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.
令NO2和NO的物质的量分别为1mol、1mol,根据电子转移守恒可知:
n(Cu2S)×[6﹣(﹣2)+1×2]=1mol×(5﹣4)+1mol×(5﹣2),解得n(Cu2S)=0.4mol.
由硫元素守恒可知n(CuSO4)=n(Cu2S)=0.4mol,
根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)﹣n(CuSO4)=2×0.4mol﹣0.4mol=0.4mol.
由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=2×0.4mol+1mol+1mol=2.8mol.
所以实际参加反应的Cu2S与HNO3的物质的量之比为n(Cu2S):n(HNO3)=0.4mol:2.8mol=1:7,
故选B.
点评: 本题考查氧化还原反应的基本概念与计算,难度中等,判断元素化合价变化,利用电子转移守恒与元素守恒计算是关键,转移守恒思想在氧化还原反应计算中的运用.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
(1)氯气可以用于漂白、消毒的原因是氯气能与水作用形成具 性(选填“氧化”或“还原”)的次氯酸,相关反应的化学方程式为 ;
(2)在对游泳池水中通入氯气的消毒时,当发生氯气泄漏,应立即关闭氯气罐,还应采取下列自救方法 .(选填序号)
A.用湿润的毛巾捂住口鼻跑向低处
B.用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C.用浸湿浓氨水的毛巾捂住口鼻匍匐逃离
D.用浸湿食盐水的毛巾捂住口鼻顺风逃离
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是 (填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物X,经过下列变化后可在一定条件下得到乙酸乙酯.则有机物X是( )

|
| A. | C2H5OH | B. | C2H4 | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不科学的是( )
A. 自然界“水滴石穿”的主要原因用方程式表示为:CaCO3+H2O+CO2═Ca(HCO3)2
B. “雨后彩虹”是与胶体、光学等知识有关的自然现象
C. 人类目前直接利用的能量大部分是由化学反应产生的
D. “生物固氮”是指植物通过叶片直接吸收空气中的氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
在120℃的条件下,总质量为2.1g的CO与H2的混合气体在足量的O2中充分燃烧,然后通过足量的Na2O2固体,固体增加的质量为( )
A. 7.2g B. 4.2g C. 2.1g D. 3.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
向100mL 0.1mol•L﹣1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L﹣1 Ba(OH)2溶液. 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
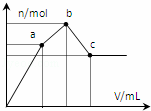
A. a点对应的沉淀只有BaSO4
B. c点溶液呈碱性
C. b点发生反应的离子方程式是:Al3++2SO42﹣+2Ba2++3OH﹣═Al(OH)3↓+2BaSO4↓
D. c点加入Ba(OH)2溶液的体积为200mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 过量的NaHSO4与Ba(OH)2溶液反应 Ba2++OH﹣+H++SO42﹣═BaSO4↓+2H2O |
|
| B. | NH4HCO3溶液与过量的NaOH溶液反应 NH4++OH﹣═NH3↑+H2O |
|
| C. | 苯酚钠溶液中通入少量CO2 |
|
| D. | FeBr2溶液中通入过量Cl2 2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法正确的是( )
A. 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜
B. 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸
C. 相同质量的铜分别与足量的等体积的浓硝酸和稀硝酸反应,生成溶液分别为绿色和蓝色,是由于反应时产生的铜离子浓度前者大于在后者
D. 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com