
分析 (1)发生反应:NaOH+HCl═NaCl+H2O、Na2CO3+2HCl═2NaCl+CO2↑+H2O,根据碳原子守恒可知n(Na2CO3•nH2O)=n(Na2CO3)=n(CO2),根据Na+守恒计算n(NaOH),进而计算NaOH 的质量分数;
(2)计算Na2CO3•nH2O的摩尔质量,进而计算n值.
解答 解:有关化学方程式:NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O,
(1)根据碳原子守恒:n(Na2CO3•nH2O)=n(Na2CO3)=n(CO2)=$\frac{3.36L}{22.4mol•L}$=0.15mol,
根据Na+守恒,有n(NaOH)=0.1L×4mol/L-0.15mol×2=0.1mol,
所以m(NaOH)%═$\frac{0.1mol×40gmo{l}^{-1}}{28g}$×100%=14.3%,
答:原混合物中NaOH 的质量分数为14.3%;
(2)M(Na2CO3•nH2O)=$\frac{28g-4g}{0.15mol}$=160g/mol,所以:n=$\frac{160-106}{18}$=3,
答:Na2CO3•nH2O 中的n=3.
点评 本题考查混合物计算,难度中等,注意利用守恒法进行计算,侧重对学生思维能力的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
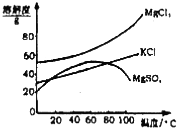
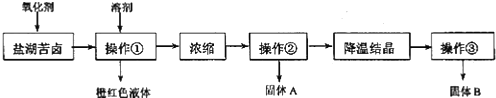
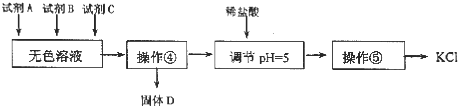
| A. | 要从橙红色液体中分离出单质溴,可采取的操作是蒸馏 | |
| B. | 操作②为过滤,主要目的是为了除去 MgSO4 | |
| C. | 试剂 C为K2CO3,固体D主要为Mg(OH)2、BaSO4,还有少量的BaCO3 | |
| D. | 若在操作④结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
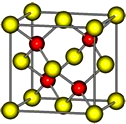 有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
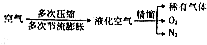
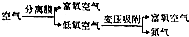
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化镁中混有氧化铝 | B. | 氯化铝溶液中混有氯化铁 | ||
| C. | 氧化铁中混有二氧化硅 | D. | 氯化亚铁溶液中混有氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
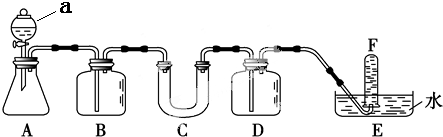
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和碳酸氢钠溶液 | |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com