
【题目】丙烯酸的结构简式是:CH2![]() CHCOOH。试写出它与下列物质反应的方程式。
CHCOOH。试写出它与下列物质反应的方程式。
(1)氢氧化钠溶液________________________________________。
(2)溴水________________________________________。
(3)乙醇________________________________________。
(4)氢气________________________________________。
【答案】(1)CH2=CHCOOH+NaOH![]() CH2=CHCOONa+H2O
CH2=CHCOONa+H2O
(2)CH2=CHCOOH+Br2![]() CH2BrCHBrCOOH
CH2BrCHBrCOOH
(3)CH2=CHCOOH+C2H5OH![]() CH2=CHCOOC2H5+H2O
CH2=CHCOOC2H5+H2O
(4)CH2=CHCOOH+H2![]() CH3CH2COOH
CH3CH2COOH
【解析】
丙烯酸中含有碳碳双键和羧基,据官能团的性质书写方程式。
(1)丙烯酸结构中含有羧基,能够与氢氧化钠溶液发生中和反应,化学方程式为:CH2=CHCOOH+NaOH![]() CH2=CHCOONa+H2O;
CH2=CHCOONa+H2O;
(2)丙烯酸结构中含有碳碳双键,与溴发生加成反应,化学方程式为:CH2=CHCOOH+Br2![]() CH2BrCHBrCOOH;
CH2BrCHBrCOOH;
(3)丙烯酸结构中含有羧基,在一定条件下可以和醇羟基发生酯化反应,化学方程式为:CH2=CHCOOH+C2H5OH![]() CH2=CHCOOC2H5+H2O;
CH2=CHCOOC2H5+H2O;
(4)丙烯酸结构中含有碳碳双键,一定条件下与氢气发生加成反应,化学方程式为:CH2=CHCOOH+H2![]() CH3CH2COOH。
CH3CH2COOH。


科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(2)NH3BH3分子中,N—B化学键称为____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+![]() +9H2,
+9H2,![]() 的结构如图所示:
的结构如图所示: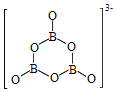 ;在该反应中,B原子的杂化轨道类型由______变为______。
;在该反应中,B原子的杂化轨道类型由______变为______。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是_________(写分子式),其熔点比NH3BH3____________(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
(4)研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
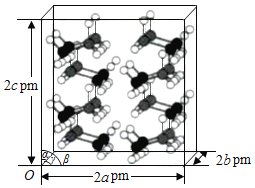
氨硼烷晶体的密度ρ=___________g·cm3(列出计算式,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以确保化学实验的绿色化。
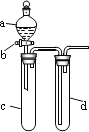
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL的浓硝酸。反应一段时间后,再由a向c中加2 mL蒸馏水,c中的实验现象有什么变化___________。
方案 | 甲 | 乙 | 丙 |
反应物 | Cu、浓HNO3 | Cu、稀HNO3 | Cu、O2、稀HNO3 |
(3)如表所示是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________,理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成一种用于合成 γ 分泌调节剂的药物中间体,其合成的关键一步如图。下列有关化合物甲、乙的说法正确的是
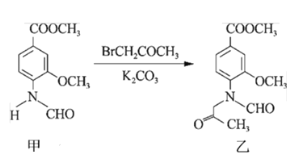
A.甲→乙的反应为加成反应
B.甲分子中至少有 8 个碳原子在同一平面上
C.甲、乙均不能使溴水褪色
D.乙与足量 H2 完全加成的产物分子中含有 4 个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO42H2O)的常用流程如图:

下列说法不正确的是( )
A.过程Ⅰ、Ⅱ中起催化剂作用的物质是Mn(OH)2
B.常温下,56gCaO溶于水配成1L溶液,溶液中Ca2+的数目为6.02×1023个
C.将10L上清液中的S2-转化为SO![]() (S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
(S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
D.过程Ⅱ中,反应的离子方程式为4MnO![]() +2S2-+9H2O=S2O
+2S2-+9H2O=S2O![]() +4Mn(OH)2↓+10OH-
+4Mn(OH)2↓+10OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇反应制备乙稀,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?_____(用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g) ,按气流的方向,各装置的连接顺序是:__________。
① |
② |
③ |
④ |
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中深水颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是___________,B瓶的作用是________, C瓶的作用是____________。
(4)装置②中所加的试剂名称是__________,它可以验证的气体是__________,简述确定装置②在整套装置中的位置的理由是______________。
(5)装置③中所盛溶液的名称是__________,它可以用来验证的气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可丁是一种药物,该药物适用于刺激性干咳病人服用,无成瘾性,化合物H是制备该药物的重要中间体,合成路线如下:
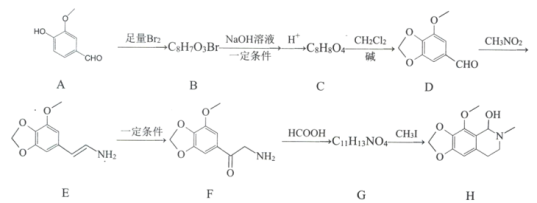
已知:①
②RNH2 ![]() RNHCH3
RNHCH3
(1)化合物B的结构简式:________。
(2)反应B→C的第一步反应类型:____________。
(3)下列说法正确的是:___________。
A 物质D能与FeCl3发生显色反应 B 物质F具有碱性
C 物质G能和银氨溶液发生反应 D 物质H的分子式是C12H15NO4
(4)写出C→D的化学方程式:____________。
(5)请写出化合物H满足下列条件的所有同分异构体的结枸简式:_______________。
①分子中含苯环,无其他环状结构
②分子中含有NO2且直接连在苯环上
③分子中只有3种不同化学环境的氢
(6)已知CH2=CHCH3![]() CH2CHCH2Cl,请以
CH2CHCH2Cl,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物![]() ,写出制备的合成路线流程图(无机试剂任选)______________。
,写出制备的合成路线流程图(无机试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是
在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是![]()

A.x与同主族且相邻元素的气态氢化物的沸点,前者高于后者
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.x的气态氢化物与w的最高价氧化物的水化物反应只能生成一种盐
D.x与H、O元素形成的化合物可以组成一种盐,其中![]() 元素原子个数之比为2:4:3
元素原子个数之比为2:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl(用R代表),请根据其组成的元素和结构回答下列问题:
(1)氮原子价层电子的轨道表达式为_____________________。
(2)第一电离能N______O(填“>”、“<”或“=”),其原因是_____________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
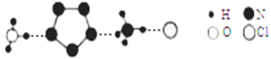
①R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为________个。大π键可用符号πmn表示,其中m为形成大π键的原子数,n为形成大π键的电子数,则N5-中的大π键应表示为__________。
③图中虚线代表氢键,其表示式为(NH4+)NH…Cl、___________、____________。
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:
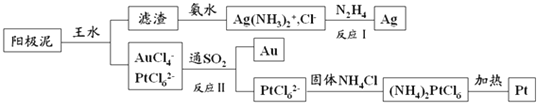
①滤渣的成分是_____________,(NH4)2PtCl6中配体是_______________________。
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是____________________,试写出该反应的化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com